巨大な遺伝子を搭載できる
ヒト人工染色体(HAC)ベクターを開発
ゲノム情報が解読され、遺伝子を操作・改変できるようになり、遺伝子治療や再生・細胞医療が行われるようになっている。こうした次世代医療には、実は「遺伝子を細胞に運ぶ」技術が欠かせない。これまで根治の難しかった疾患の治療に大きな役割を果たす次世代ベクター(運び屋)として、世界で注目が高まっているのが、「ヒト人工染色体(HAC:Human Artificial Chromosome)」だ。
宇野愛海助教らは、ヒト染色体から遺伝子領域を取り除き、セントロメアとテロメアという基本構造だけを持つヒト人工染色体(HAC)を作製する技術を開発している。HACの最大の特長は、数百万塩基対(メガベース)規模の巨大な遺伝子を搭載できるところにある。それに加えて、導入しても宿主の染色体に挿入されず、独立して保持されるので、宿主の遺伝子を傷つけず、安全に遺伝子を導入できるという強みもある。
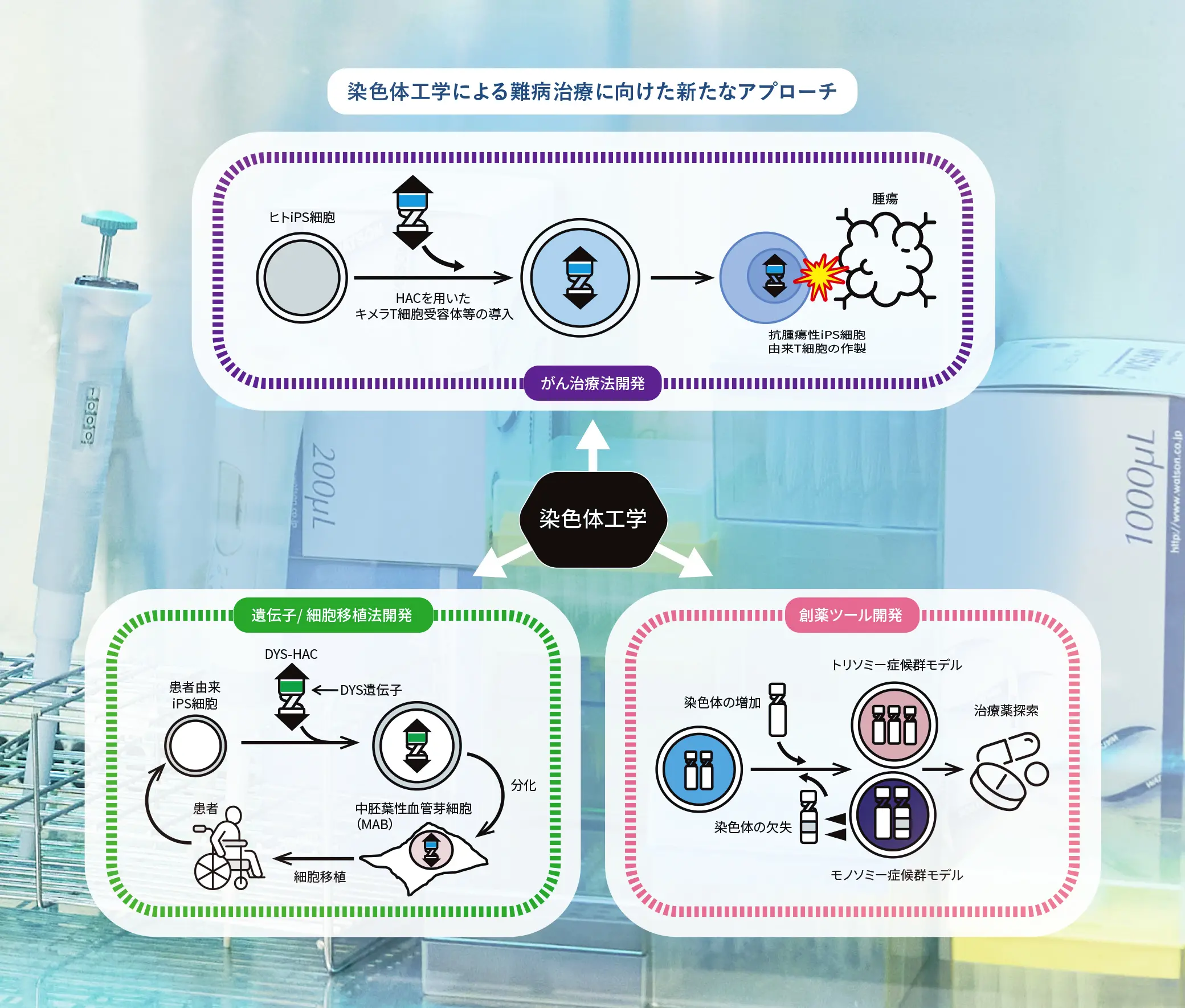
また宇野助教らは、HACを「別の細胞に移す」技術も確立している。染色体供与細胞から微小核細胞を取り出し、受容細胞(染色体を移入される側の細胞)と融合する。この「微小核細胞融合法(MMCT法)」によって、特定の染色体をiPS細胞を代表とし、別の細胞に導入することを可能にした。「このHACベクターを応用し、がんなど難治疾患の治療法の開発や、遺伝子・細胞移植法の開発、創薬ツールの開発に取り組んでいます」と言う。
HACベクターを用いて
新たに「再生CAR-T細胞療法」を開発
現在力を注いでいるのが、最新のがん免疫療法「CAR-T細胞療法」をブラッシュアップさせた「再生CAR-細胞療法」の開発だ。
「CAR-T細胞療法」では、がん患者自身の免疫細胞(キラーT細胞)を取り出して、がん細胞を攻撃するよう設計されたCAR(キメラ抗原受容体)を作るCAR-T細胞に改変し、患者の体内に戻す。しかしCAR-T細胞のがん細胞への攻撃能を強化するために多くの遺伝子を導入するのが非常に困難な上に、患者自身の細胞を使用するため、高価でしかも細胞の品質にバラツキが出ることが課題となっている。宇野助教らは京都大学との共同研究で、HACベクターとiPS細胞を使って、これらの課題を一気に解決する「再生CAR-T細胞」の作製に成功した。
「まずT細胞を高機能化するサイトカインを搭載したユニットとCAR交換ユニットをHACに搭載し、それをiPS細胞に導入してHAC-iPS細胞を作製します。このHAC-iPS細胞を分化させ、高機能なCAR-HAC-iPS-T細胞を作製しました」。HACベクターによって巨大な遺伝子群の導入を可能にすることで、iPS細胞由来の均質な「iCAR-T細胞」を安定して作製することを可能にした。
実際にin vitroでCAR-HAC-iPS-T細胞を作製し、解析したところ、CAR-HAC保持iPS細胞から効率的にT細胞が分化・誘導されることが示された。またCAR-HAC-iPS-T細胞に抗腫瘍活性があることも認められた。
現在はHACに搭載するT細胞活性因子をさらに増やし、CAR-HAC-iPS-T細胞をより高機能化できるか、検証を行っている。将来は、高機能で汎用性の高い「再生CAR-T療法」として、臨床応用することを見据えている。

ジストロフィン遺伝子の修復と細胞の移植を実現
またHACを用いて、遺伝子・細胞移植療法も開発している。その一つとして、筋ジストロフィーの治療を可能にする遺伝子修復と細胞移植に取り組んだ。
デュシャンヌ型筋ジストロフィー(DMD)は、ジストロフィン遺伝子の変異によってジストロフィンタンパク質を作れなくなり、骨格筋障害が生じる遺伝子疾患だ。「治すにはジストロフィン遺伝子を修復する必要がありますが、ジストロフィン遺伝子は、全長2.5Mb(250万塩基対)に及ぶ巨大な遺伝子で、ウィルスベクターなど既存のベクターでは運ぶことができないため、遺伝子治療は困難といわれてきました」。これまでに宇野助教らは、ジストロフィン遺伝子全長を搭載したHAC(DYS-HAC)をDMD患者由来の繊維芽細胞に導入し、それからiPS細胞を樹立した。このDYS-HAC保持iPS細胞のDNAを解析し、ジストロフィンの発現に必要な遺伝子がすべて修復されていることを確認している。
さらなる難題は、DYS-HAC保持iPS細胞をDMD患者に移植することだ。宇野助教はイタリアの研究グループとの共同研究で、筋ジストロフィー(mdx)マウス由来の中胚葉系血管芽細胞にDYS-HACを導入してジストロフィン遺伝子を修復した筋芽細胞を作製し、これをmdxモデルマウスへの移植を試みた。「解析の結果、マウスの筋内繊維にジストロフィンタンパク質の発現が認められました。また移植後6カ月間で、モデルマウスの運動量が増え、筋機能が回復していることも確認できました」。これらからHACベクターを使った遺伝子治療・細胞治療に大きな可能性が見えてきた。
「HACは、創薬ツールとしても非常に有用です」と宇野助教。これまでにダウン症候群モデルiPS細胞を作製している。
ダウン症候群は、ヒト21番染色体のトリソミー(正常2本の染色体が3本になること)によって引き起こされる染色体異数性疾患である。いまだ根治的な治療法はなく、その開発が待たれている。宇野助教らはMMCT法で、ヒト21番染色体を、別の正常なヒトiPS細胞に導入。ダウン症候群モデル(トリソミー21)iPS細胞を樹立した。そのほかにもX染色体を導入したトリプルX症候群モデルiPS細胞、Y染色体の導入によるクラインフェルター症候群モデルiPS細胞の作製も達成している。これらのモデル細胞が、近い将来、ダウン症候群の原因遺伝子の解明や治療法・治療薬の開発に寄与する重要な研究ツールとなるかもしれない。