タンパク質と聞くと、栄養素、筋肉増強のための栄養素と思う人も多いかもしれない。タンパク質が栄養素として重要なのは、タンパク質を消化してできるアミノ酸が生物に必要だからである。
なんでアミノ酸が必要か。アミノ酸は、生物の体の中で再びタンパク質になる。タンパク質は、筋肉になって体を動かし、化学反応の触媒(酵素)として機能している。タンパク質は、ヒトの身体を構成する有機物の約半分を占めている。タンパク質の材料としてアミノ酸が必要である。
なんで、一度タンパク質を分解してまたタンパク質を作るという面倒なことをするのか。ウシのタンパク質はヒトのタンパク質とは異なっているので、ヒトはウシのタンパク質を使えないからである。ヒトやウシに限らず全ての生き物は、自分用のタンパク質を自分でアミノ酸から作っている。
タンパク質の構造
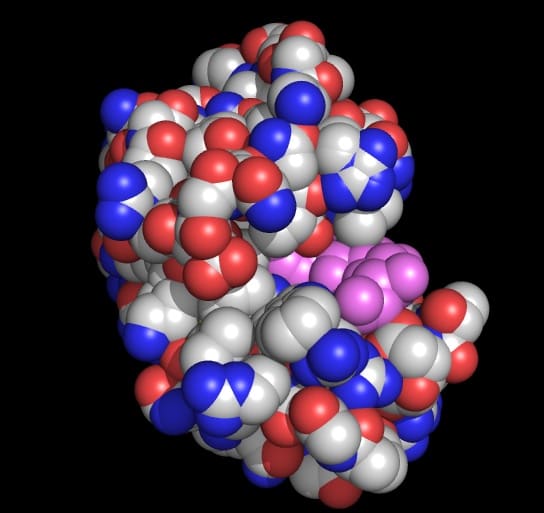
タンパク質の構造は、タンパク質の種類ごとに決まっている。例えば、上の図はリゾチームという名前のタンパク質の構造である。この図で、原子が適当に積み重なっている様に見えるかもしれないが、そうではない。タンパク質ごとに、厳密にこの積み重なりかたが決まっている。例えば、タマゴの卵白1g中に1013分子のリゾチームがあるが、そのすべてのリゾチーム分子は上図の様な構造をしている。
タンパク質の機能
触媒反応を受ける基質(上図の紫色:細菌の細胞壁)は、リゾチームの構造の凹みに丁度はまり込む。リゾチームのその部位には触媒活性を示すアミノ酸があり、それが細胞壁を切断する。細菌はやがて死滅する。細胞壁がはまり込む構造をもつことが、リゾチームの機能にとって重要なわけである。
生物の体には、数万種類のタンパク質がある。数万種類のタンパク質はそれぞれ特有の構造をもっていて、それぞれ特有の機能を発揮して生命活動を担っている。タンパク質の構造が分かれば、その機能の理解に近づき、そのタンパク質を標的とした創薬も容易になる。
タンパク質の構造が決まる仕組み
タンパク質の構造が決まる仕組みは、水などの液体が凍る時の仕組みに似ている。原子と原子をつなぐ結合(共有結合)は、できるかぎり安定な長さと角度になる。互いに共有結合していない原子同士は、相互作用(ファンデルワールス力、クーロン力)が安定な位置に移動する。こうした力のバランスがとれた最安定な位置が図の構造なので、常温の水中でタンパク質は自然にこの構造になる。
タンパク質の構造は遺伝子によってきまる
このタンパク質の構造は、タンパク質のアミノ酸配列(アミノ酸の並び順)によって決まる。タンパク質は20種類のアミノ酸でできているが、20種のアミノ酸は構成原子(炭素、水素、酸素、窒素、硫黄)の数とつながり方がアミノ酸種によって異なっている。したがって、20種のアミノ酸は互いに形が異なり、電子の分布も異なっている。その結果、タンパク質はアミノ酸配列で決まる固有の原子配置になり、原子に働く力に応じた固有の構造をとるようになる。つまり、タンパク質の構造は遺伝子で決まるアミノ酸配列にしたがって、最安定な構造になる。
タンパク質の構造は進化の結果
では、どのように各タンパク質のアミノ酸配列が決まったのか。各タンパク質のアミノ酸配列は、生物の進化の過程で決まった。生物はダーウィン進化(名誉教授コラム「チャールズ・ダーウィンはかく語りき」)してきた。進化の過程で、環境に適した個体がより高い生存確率をもつことで選択された。この「環境に適した」ということを実現するタンパク質を持つ個体が選択された。その過程で、環境に適したタンパク質機能と構造を実現するアミノ酸配列(遺伝子)が選択された。つまり、タンパク質のアミノ酸配列と構造は進化によって選択された。
タンパク質立体構造推定法
タンパク質が立体構造を作る原理は分かっている。その原理にしたがって計算すれば構造が推定できるはずである。しかし、現在の計算機の能力で、物理的原理からタンパク質立体構造を推定することはできない。それは、現在の計算機の能力で精度の高い原理計算をすることができないからである。そこで近似計算を行うのだが、近似計算の誤差が大きく、十分な精度で計算することができない。
そこで、グーグル・ディープマインド(Google DeepMind)社は、全く異なるタンパク質構造推定法アルファフォルドを開発した(Senior et al. 2020)。その方法の特徴は、相同配列からアミノ酸間の距離を推定するという方法である(解説はYang et a. 2023)。相同な配列では、近接するアミノ酸は同時に変化する場合が多い。これを利用してアミノ酸間距離を推定する。また既知のタンパク質構造を学習して、構造未知アミノ酸配列のアミノ酸間距離と角度(主鎖二面角、アミノ酸面の相対方向)を推定する。次いで、アミノ酸間距離と角度からタンパク質の大まかな構造を推定する。最後に、物理的整合性を評価することで最安定なタンパク質構造を推定する。
現在カタログ化されているタンパク質のほとんど全て、2億個のタンパク質の立体構造が推定され、データベースとして公開されている(AlphaFold 2025)。
この推定法、アルファフォルドを開発したチームのデミス・ハサビス(Demis Hassabis)とジョン・ジャンパー(John Jumper)は、「タンパク質の構造予測」の業績によって2024年のノーベル化学賞を受賞した。
AlphaFold (2025) https://deepmind.google/science/alphafold/
Senior, A.W. et al. (2020) Nature 577, 706-710.
山岸明彦(2016) アストロバイオロジー―地球外生命体の可能性. 丸善出版
Yang, Z. et al. (2023) Signal Transduct Target Ther. 8, 115.