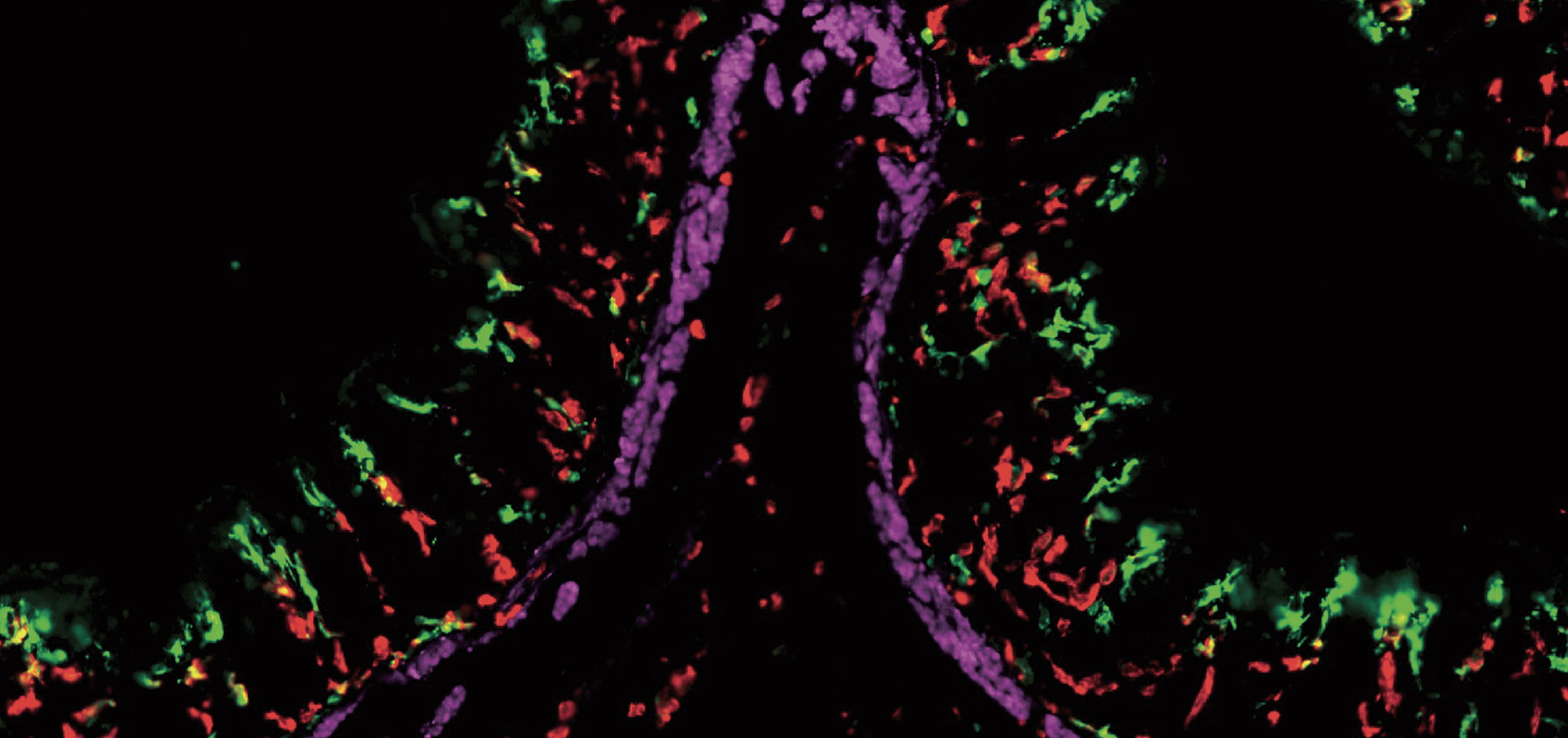
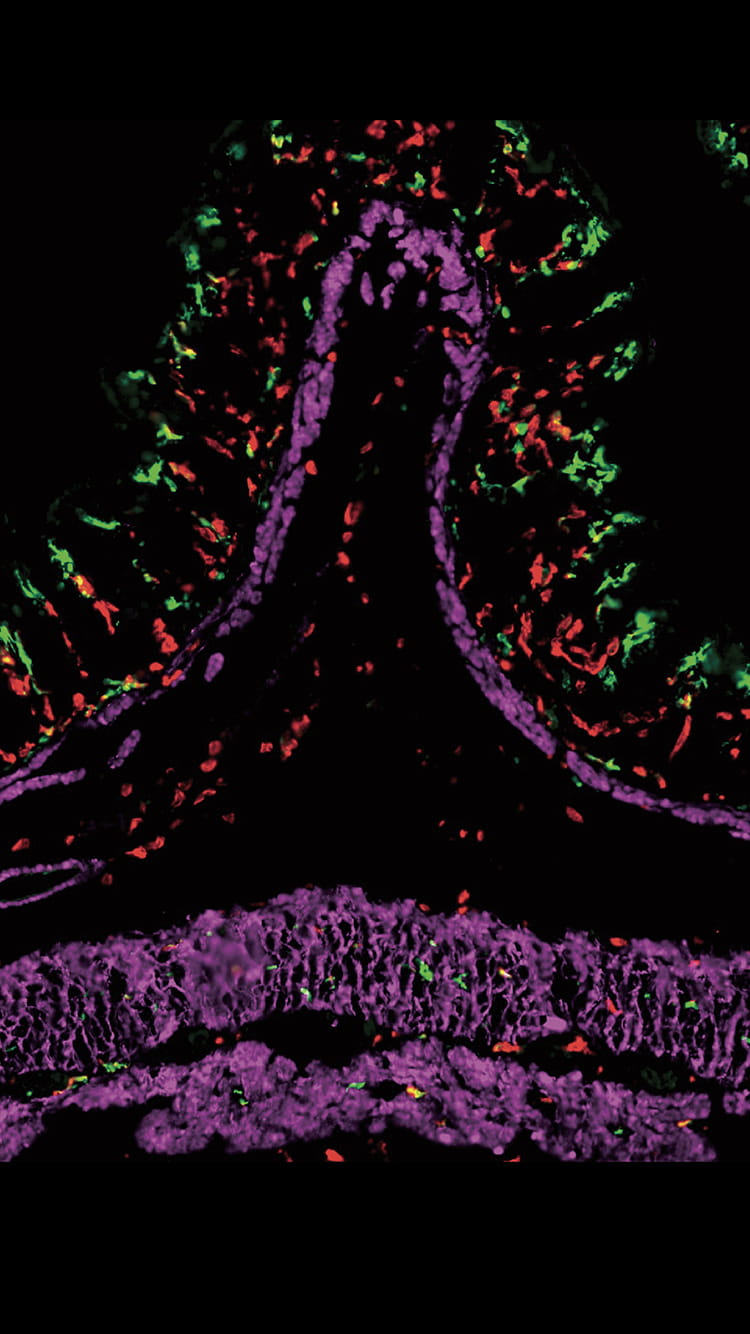
細胞の死骸を食べるマクロファージの働きに注目
生体には、不要になった細胞や有害な細胞を自ら死に向かわせて排除するという細胞死のプログラムが備わっている。アポトーシスと呼ばれるこの細胞死によって日々少しずつ細胞が入れ替わることで、私たちの身体は維持されているのだ。
しかし毎日約3000億個もの細胞が死んでいるにも関わらず、体内にその死骸はほとんど見当たらない。理由はマクロファージなどの食細胞が死骸を速やかに貪食しているためだ。田中正人教授は、アポトーシス研究において世界をリードしてきた研究者の一人であり、マクロファージのユニークな働きにも早くから関心を注いできた。
マクロファージが生きた細胞を決して食べず、死んだ細胞だけを貪食するメカニズムを明らかにしたのも、研究成果の一つだ。田中教授は大阪大学の長田重一教授の研究室で、死細胞に現れるシグナルを認識するマクロファージの遺伝子MFG-E8を同定し、死細胞とマクロファージを橋渡しして貪食を促す分子機構を解明した。「細胞死が起こると、死細胞の表面に特有のリン脂質が現れます。マクロファージはこの“Eat me signal”を特異的に認識する遺伝子MFG-E8を持っており、それがリン脂質と結合してマクロファージの貪食を促進することを確かめました」。
がん免疫を活性化するマクロファージを発見
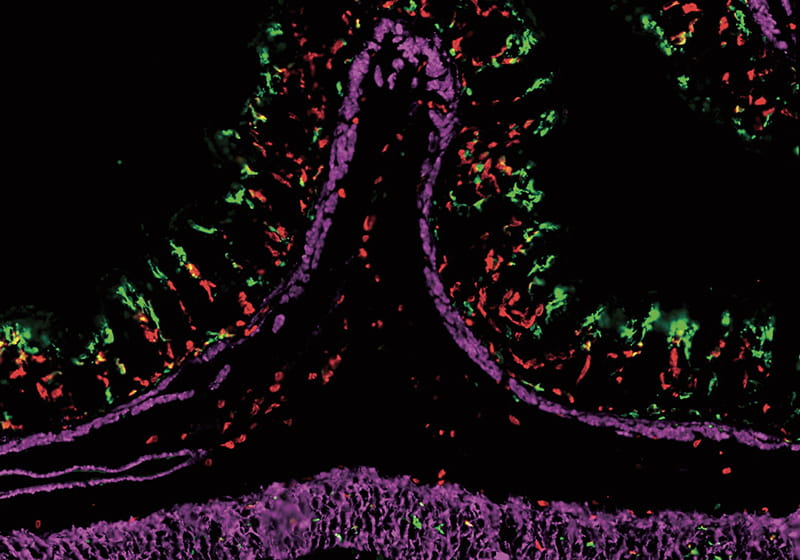
最近の研究で、マクロファージは単に死細胞を貪食するだけでなく、それを分解・再利用することによって、さまざまな免疫応答を制御していることがわかってきたという。マクロファージの貪食現象がどのような役割を果たしているのか、田中教授は明らかにしようとしている。
その一つとして注目するのが、がんの死細胞ががんの増殖を抑制する現象だ。「放射線治療や化学療法でがん細胞を殺すと、死んだがん細胞を免疫系が認識してがんに対する免疫が活性化し、がんの増殖を抑えることが知られています。しかしどのような仕組みでがん免疫が誘導されるのか、詳しいメカニズムはわかっていませんでした」。
田中教授は、マウスを使った実験で、がんの死細胞を貪食してがん免疫を活性化するCD169陽性マクロファージを同定することに成功。D169陽性マクロファージが死んだがん細胞を認識し、がん細胞を殺すメカニズムを解き明かした。「CD169陽性マクロファージは、リンパ節の外側で待ち構えていて、がんの死細胞を貪食します。その際、食べた死細胞に含まれるがん抗原を提示して、がんのキラー細胞である細胞傷害性T 細胞を活性化させ、がん細胞を殺すという仕組みです」。田中教授はその後の研究で、CD169陽性マクロファージが多くの組織で免疫制御を司り、がんだけでなく、炎症性腸疾患や虚血性臓器障害などの病態に関与していることも確かめている。
炎症を抑えて組織の修復を促す免疫細胞の存在を初めて実証
最近の研究では、炎症や組織傷害の回復期に出現し、組織修復を促す新しい免疫細胞を発見している。
細菌感染や組織傷害を負うと、もともと組織に存在するマクロファージに加えて、骨髄からマクロファージの基になる血球細胞(単球)が供給され、炎症などの免疫応答を起こす。「炎症が起こった後、炎症を抑えて組織の修復を促すマクロファージや単球の由来については、二つの可能性が指摘されてきました」と田中教授。一つは、同一のマクロファージが炎症の誘導と炎症収束・組織修復の両方に働く可能性だ。しかし同じ細胞が急性期と回復期でどのように正反対の働きをするのかはわからなかった。一方、田中教授が考えたのは、炎症を起こすマクロファージとは別に、炎症を抑えるマクロファージの基(単球)が骨髄で産生される可能性だ。
それを確かめるために田中教授が着目したのは、Ym1というタンパク分子だった。Ym1は炎症収束や組織修復を担うマクロファージに発現することが報告されているため、これをマーカーとして利用しようと考えたのだ。そこでYm1を発現する細胞(Ym1陽性単球)を蛍光標識したマウスを作製し、追跡を試みた。
「全身炎症を引き起こすLPSというリポ多糖を投与したマウスのYm1陽性単球の動態を解析すると、LPSを投与してから炎症がピークを迎えるまでの2~24時間は、Ym1陽性単球数にほとんど変化はありませんでした。ところが炎症が収まり、回復していく48時間後、Ym1陽性単球の数が爆発的に増えたのです」。この細胞数の増加は、単球が産生される骨髄でも見られたことから、Ym1陽性単球は、炎症の回復期に骨髄で増産されたものだとわかる。このような組織を修復する単球の存在を証明したのは、田中教授の研究が初めてだった。つまり同じマクロファージが働きを変えるのではなく、急性期と回復期で骨髄から異なる細胞が産生されるという田中教授の仮説が裏づけられたわけだ。さらに教授は、大腸炎の腸管局所炎症モデルを用いた実験でも、Ym1陽性単球が同様の機能を果たすことを示す結果を得ている。
Ym1陽性単球を効率よく増やすことができれば、傷害を受けた臓器の修復を促進する治療薬を開発できるかもしれない。また反対に、がんなどの悪性腫瘍の組織修復プロセスを妨げられる可能性も出てくる。田中教授はこうしたさまざまな免疫制御機構を解明し、がんや自己免疫疾患の治療に役立つ創薬につなげようとしている。