タンパク質の翻訳後修飾が遺伝子の発現パターンを決定づける
ヒトの身体は37兆個もの細胞でできているが、もとはたった一個の受精卵から分化したため、37兆個の細胞のDNAの塩基配列はすべて同じである。にもかかわらず、胃や肝臓など別々の形や機能を持った組織ができるのは、各細胞で必要な遺伝子だけが発現するからだ。細胞にどの遺伝子を発現するかは、遺伝子の配列を見ただけでは分からない。
「細胞内のDNAは、ヒストンというタンパク質に巻きついて核の中に存在しています。ヒストンタンパク質は、遺伝子の塩基配列が翻訳された後に修飾を受け、メチル化、アセチル化といった、いわば『目印』をつけられます。この目印が遺伝子の発現パターンを調節し、どのような細胞になるかを決定づけているのです」と説明するのは、伊藤昭博教授。教授によると、この翻訳後修飾が正常に行われないと、さまざまな疾患の原因になるという。代表的なのが、がんだ。伊藤教授は、タンパク質の翻訳後修飾を標的として、新しい生命機能調節機構を解明するとともに、疾患との関係を明らかにし、創薬へとつなげようとしている。「タンパク質の翻訳後修飾は、酵素によって制御されています。遺伝子変異を正常にするのは容易ではないが、酵素の活性を調節して遺伝子の発現パターンを正常に戻すことなら可能です」として、翻訳後修飾に作用する酵素を突き止め、その活性を調節する化合物を探索している。
遺伝子の発現パターンを操作して鎌状赤血球症の治療薬を作る
成人のヘモグロビンはα鎖とβ鎖を2本ずつ持つが、鎌状赤血球症は、β鎖が変異して酸素との結合親和性が低下し、重篤な貧血になる遺伝性の疾患だ。日本ではほとんど患者がいないが、世界を見ると毎年30-40万人の新生児が鎌状赤血球症を発症しており、新しい治療薬の登場が強く望まれている疾患である。ヘモグロビンは、胎児の時はα鎖とγ鎖から成っているが、生まれた後成人型に変わっていく。βグロビン遺伝子の変異を元に戻すことは難しいが、成人で眠っている胎児型ヘモグロビン遺伝子を再び呼び起こす(発現させる)ことができれば、酸素と結合できるようになる。そのような化合物は、鎌状赤血球症の治療薬になりうる。伊藤教授はそのようなアイデアのもと、胎児型ヘモグロビン遺伝子の発現を誘導する化合物として、ヒストンメチル化酵素阻害剤を見つけてきた。現在、創薬を目指して研究を進めるとともに、そのメカニズムの究明に取り組んでいる。
コータクチンのアセチル化ががん転移を抑える機構を解明
がんは、無限に増殖するだけでなく、他の組織に浸潤したり、転移することで増大していく。この転移を抑えられれば、がん治療も大きく進展するに違いないが、残念ながらそのような治療薬はまだない。そこに一石を投じるのが、伊藤教授の研究である。教授は、コータクチンというタンパク質に注目し、がん細胞の運動を制御する機構を発見するという画期的な成果を報告している。
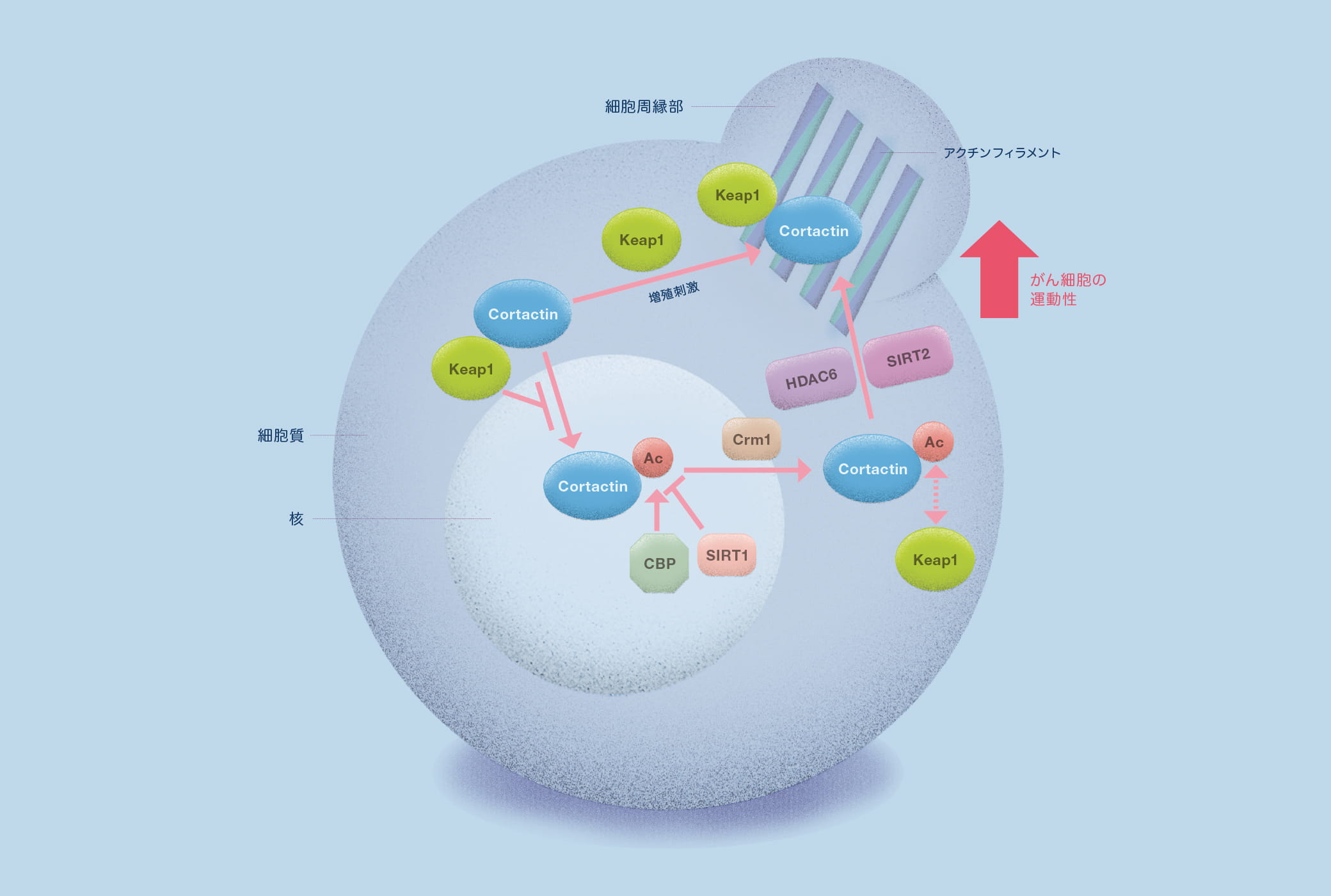
「コータクチンは、アクチン結合タンパク質の一つで、浸潤や転移といったがん細胞の運動に関わる重要な因子であることが知られています」と伊藤教授。教授によると、コータクチンは細胞内で辺縁部に移動し、そこでアクチン重合を促進してがん細胞の運動を促す。ところがコータクチンのリジン残基が翻訳後修飾によってアセチル化されると、がん細胞の運動が抑えられ、浸潤や転移は起こらないという。いったいどうしてなのか?
その謎を解くためにまず伊藤教授は、コータクチンのアセチル化酵素を探し、CBPを見出した。またその過程で、コータクチンが核と細胞質を行き来するシャトルタンパク質であることも突き止めている。
次にコータクチンの結合タンパクを探索し、見つけたのが、それまで知られていなかったKeap1(Kelch-like ECH-associated protein1)というタンパク質だった。Keap1は、従来酸化ストレス応答の制御因子とされてきたが、伊藤教授は、それとは別にKeap1がコータクチンを細胞の辺縁部に移動させ、細胞の運動を増進する機能を持っていることを発見した。「コータクチンがアセチル化されるとKeap1との結合が弱くなる。するとコータクチンは辺縁部に移動できず、がん細胞の運動性が著しく低下するのです」と伊藤教授。それまで誰も気づかなかったKeap1の新たな機能を発見したことで、がん細胞運動性を制御するメカニズムが明らかになった。
この成果は、新しいがん転移治療薬の開発にも光明をもたらす。「コータクチン自身は酵素ではないので、コータクチンを直接阻害する化合物を見つけるのは難しい。しかし、コータクチンの機能を調節するアセチル化を制御する酵素なら阻害剤を作ることが出来ます。もしコータクチンのアセチル化を妨げる脱アセチル化酵素を阻害する化合物を見つけられれば、がん転移を防ぐ薬になる可能性があります」。伊藤教授は、コータクチンの脱アセチル化酵素の一つであるSIRT2をターゲットに絞り、SIRT2を阻害する化合物を探索。有望な候補物質を同定し、現在、最適化研究を進めている。
細胞をがん化させる代謝物候補を発見
生体内には合成化合物のように、タンパク質の機能を調節する内因性代謝物が存在する。その中には、細胞をがん化させるような生体にとって危険な代謝物質もある。伊藤教授が着目したのは、HIF-1αという転写因子だった。HIF-1αは低酸素誘導因子で、酸素が十分ある状態では水酸化酵素(PHD)によって分解されるためほとんど存在しないが、酸素濃度が下がると活性化する。
伊藤教授は、通常の酸素濃度でもHIF-1αを活性化する代謝物を発見した。作用機序解析の過程で、この代謝物はPHDを阻害するだけでなく、PHDと同じα-ケトグルタル酸依存性ジオキシゲナーゼであるヒストン脱メチル化酵素とDNA 脱メチル化酵素を阻害することを見出した。「我々が発見した代謝物と同じ活性をもつ有名な代謝物が知られています。それは、細胞のがん化を誘導するオンコメタボライトである2-ヒドロキシグルタル酸です。したがって、我々が発見した代謝物もオンコメタボライトである可能性があります。2-ヒドロキシグルタル酸を産生する変異型イソクエン酸脱水素酵素の阻害剤は抗がん剤として現在臨床の場で使用されています。もし我々が発見した代謝物もオンコメタボライトであれば、その代謝物の生合成酵素を標的としたがん治療薬を作ることが出来るかもしれません」と語る。こうした研究成果から、将来、革新的な新薬が生まれることが期待される。