クリーンな反応に欠かせない有機分子触媒を設計開発
「環境汚染や資源の枯渇といった問題が深刻化する現代は、化学合成においても環境負荷の少ない方法が求められるようになっています。そんな中で、次代のクリーンな触媒として注目が高まってきたのが、有機分子触媒です」。そう語った平島真一准教授は、「それまで不可能だった反応を有機分子触媒の力で達成する」ことを目標として、グリーンイノベーションの要求に応える高い活性を持つ有機分子触媒の設計開発に取り組んでいる。
有機分子触媒は、金属触媒と比べて毒性が少なく、安価であることに加えて、湿気や酸素にも安定で、特殊な設備や技術も必要としない。とりわけ鏡像異性体の片方を選択的に合成する不斉有機分子触媒は、創薬につながる生理活性物質の合成に欠かせないツールの一つになりつつあるという。
3プロトン型水素結合共有型の新規の有機分子触媒を開発
平島准教授が精力を傾けている研究の一つが、γ-ブテノリド骨格を持つ化合物の合成である。「γ-ブテノリド骨格は天然物に含まれる基本骨格で、さまざまな生理活性を示すことが知られています。中でもδ-ヒドロキシ-γ-ブテノリドは、合成中間体としても有用で、多くの反応合成に役立っています」と言う。
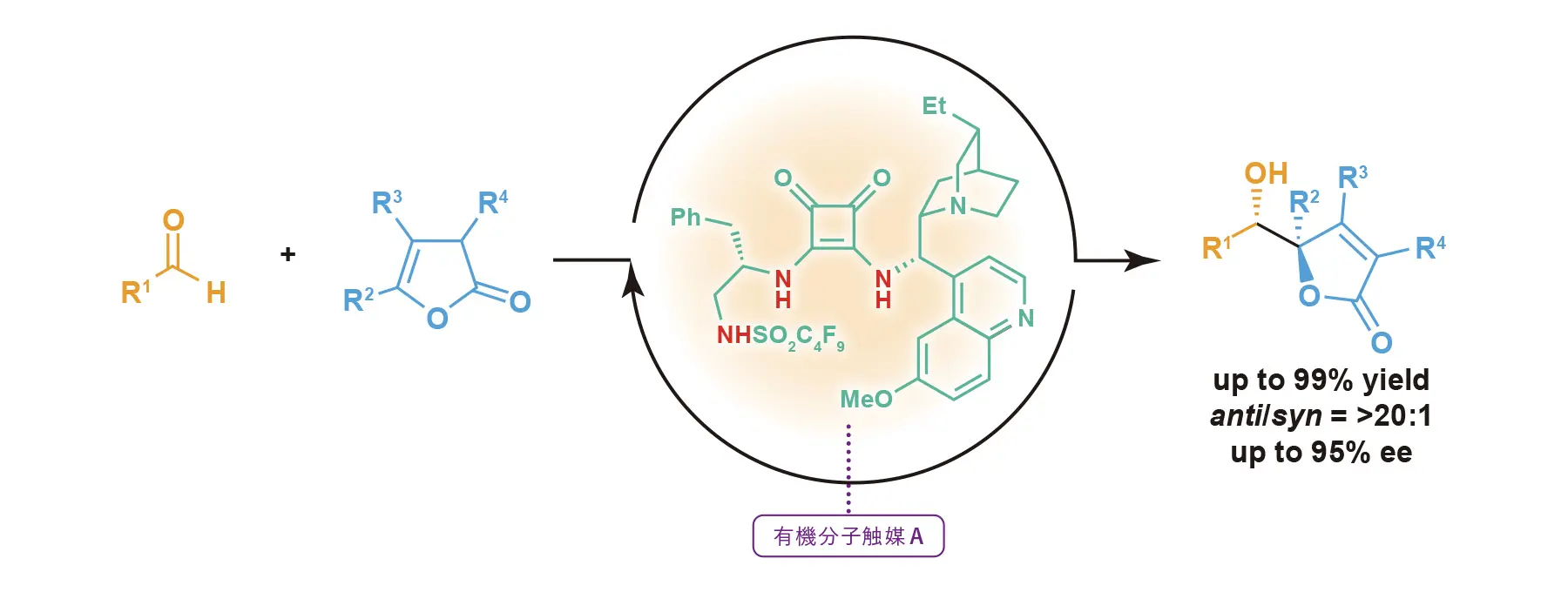
これまでの研究で、δ-ヒドロキシ-γ-ブテノリドの合成法として2-シロキシフランとアルデヒドを反応させる方法が報告されているが、その方法では合成までに3段階を必要とする。それに対し平島准教授は、「有機分子触媒を用いて2(5H)-フラノンを直接脱プロトン化してフラノラートへ活性化し、カルボニル化合物と反応させれば、1段階で目的のδ-ヒドロキシ-γ-ブテノリドを合成できるのではないかと考えました。反応工程を減らせれば、環境負荷の低減にも寄与できます」と明かす。過去に同様のコンセプトで合成の報告はあるものの、いずれも十分な収率や立体選択性を得られていないことから、新たな触媒の開発に着手した。

「触媒に三つの水素結合給与部位を配置し、そのうち二つの活性プロトンでアルデヒドを活性化し、残りの酸性プロトンと第三級アミンでフラノラートへの活性化を行えば、うまく反応が進むのではないかと仮説を立て、合成を試みました」。検討の末、三つの酸性プロトンを配置した、3プロトン型水素結合共有型触媒Aを合成(図1:有機分子触媒A)。91%という高い立体選択性で目的の化合物を得られることを見出した。さらに反応条件を検討し、収率、立体選択性共に90%を超える高立体選択的なδ-ヒドロキシ-γ-ブテノリドの合成を可能にした。
続いて平島准教授は、この触媒を用いてγ,γ-二置換-δ-ヒドロキシ-γ-ブテノリドの合成も行った。「γ,γ-二置換-δ-ヒドロキシ-γ-ブテノリドは、不斉四級炭素と不斉三級炭素が連続した立体構造をしており、その構築は非常に困難です」。平島准教授は、非共役型5-置換-フラノンを基質として、先述の触媒Aを用い、γ,γ-二置換-δ-ヒドロキシ-γ-ブテノリドを誘導する条件を考案。高い収率・立体選択性で合成を達成した(図1)。報告時点では世界初の成功例だったという。その他、さまざまなアルデヒドについても検討している。「α位やβ位に置換基を有する非共役型5-置換-フラノンを用いても、高い収率と立体選択性を得ることができました」
有機リン化合物の新たな合成法を見出す
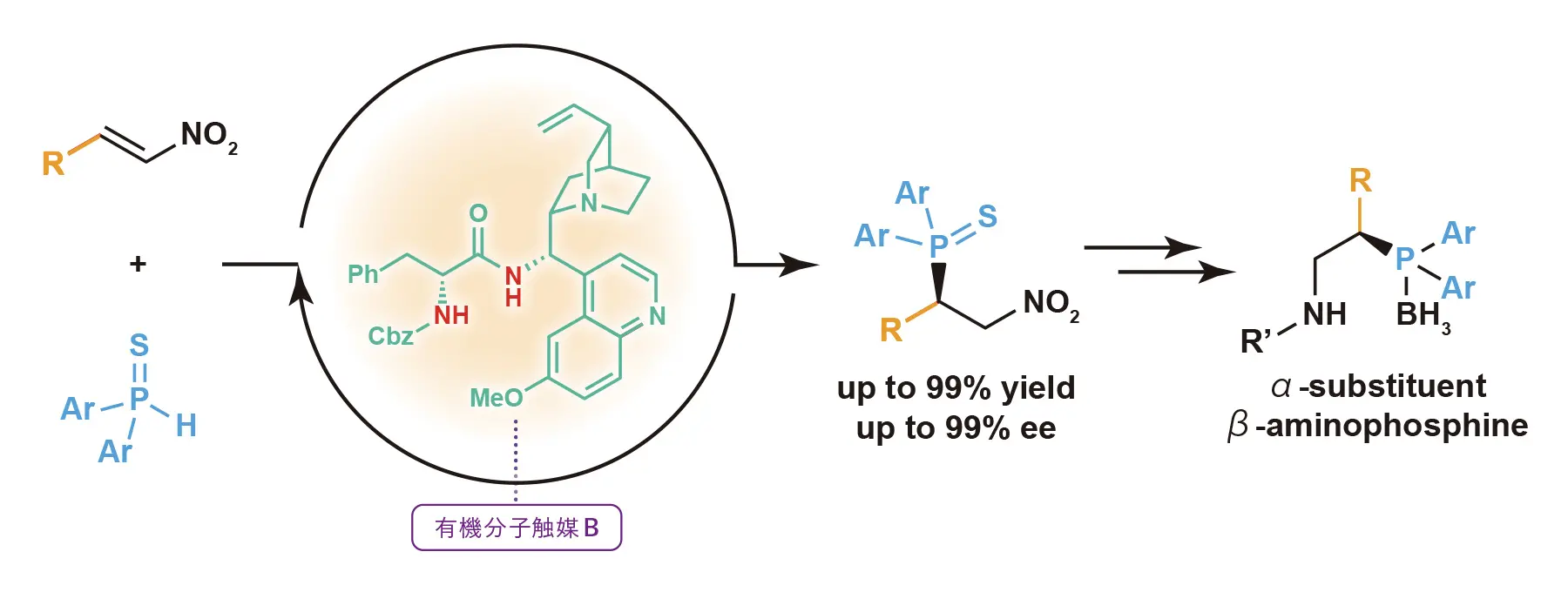
最近の研究では、有機リン化合物の新たな不斉合成を可能にする触媒構造を見出している。「有機リン化合物の一つにβ-アミノホスフィンがあります。この化合物は、アミノ酸から誘導する方法が一般的ですが、キラル(鏡像異性体の)アミノ酸からは、リン(P)のβ位に置換基を有するキラルβ-アミノホスフィンしか誘導できません。ここに課題を見た私たちは、Pのα位に置換基がついたβ-アミノホスフィンを誘導する方法を考えました」
平島准教授が考え出したのは、触媒下でニトロアルケンに第二級ホスフィンオキシドを反応させてβ-ニトロホスフィンを得て、それからα-置換-β-アミノホスフィンを誘導する方法だった。「それに加えて、求核剤の第二級ホスフィンオキシドの酸素(O)を硫黄(S)に変え、第二級ホスフィンスルフィドにすれば、酸性度と求核性を高めるだけでなく、有機溶媒への溶解性を向上させ、精製も容易になると予測しました」。実際に第二級ホスフィンオキシドと第二級ホスフィンスルフィドをそれぞれ求核剤にして反応性を比較した結果、第二級ホスフィンオキシドの場合は、23時間を経ても反応は完結せず、高い収率は得られたものの、十分な立体選択性を得ることはできなかった。一方第二級ホスフィンスルフィドでは、反応性が劇的に向上。1時間で反応を終え、十分な収率を得るとともに、立体選択性も大きく向上した。
さらに反応条件を精査した平島准教授らは、触媒Bを用いることで、収率99%、エナンチオ過剰率97%で、対応するキラルα-置換-β-アミノホスフィン誘導体を得ることに成功した(図2)。また触媒Bのキニーネの部分構造を疑似鏡像異性体のキニジンに、アミノ酸の部分構造を天然型に変えることで、生成物の鏡像異性体であるR体、S体の両方を作り分けることも可能にしている。
現在は、合成した化合物から多様な生成物を誘導し、新しい有機分子触媒への展開を検討している。今後の不斉反応の発展につながる新たな有機分子触媒の誕生に期待したい。