ヒトの血液脳(腫瘍)関門を模倣したin vitroモデルの開発
神経膠腫(グリオーマ)は、脳の神経膠細胞から発生するがんであり、極めて悪性度が高い難治性がんとして知られている。増殖性・浸潤性が高いため、外科手術で完全に腫瘍を除去することは難しく、そこにさらに放射線治療と化学療法を組み合わせた治療でも、5年生存率は10%に満たない。そのため、より効果の高い新規治療法の開発が待たれている。
「こうした脳疾患の治療を困難にしている原因の一つが、血液脳関門(Blood-brain barrier, BBB)です。BBBは、脳と血流の間に存在し、脳への異物の侵入を防ぐ、生体で最も強固なバリアとされています。やっかいなのは、このBBBが異物だけでなく薬の送達をも阻むこと。この厚い障壁を突破し得る薬として、近年、従来の低分子化合物に代わり、ペプチドや抗体、細胞、ウイルスといったニューモダリティへの注目が高まっています」と森尾 花恵助教。
創薬研究を進める上で欠かせないのが、薬物動態を確かめるための実験系である。森尾助教が所属する研究室では、ヒトのBBBの働きをin vitroで模倣するヒトBBBモデルの開発に成功している。
BBBは、脳毛細血管内皮細胞(BMEC)を実態として、その周囲をペリサイトとアストロサイトが覆う構造をしている。同研究室では、長期間細胞増殖を続けられる不死化細胞に着目。ヒト初代培養細胞に不死化遺伝子を導入して不死化BMECを樹立し、続けてペリサイト、アストロサイトの不死化も実現した。これを用いて、培養空間を2層に分け、BMECとペリサイト、アストロサイトを積層するように播種したトランスウェル型(2D)のBBBモデルと、アストロサイトを中心に、生体に寄せた配置で細胞塊になった階層スフェロイド型(3D)のBBBモデルを構築した。これを使えば、薬物の脳到達に関するさまざまな研究を一気に進めることができる。
「グリオーマの脳では、BBBと比べてバリア機能は一部破綻していますが、それでも尚薬物の送達を阻んでいる、血液脳腫瘍関門(Blood-brain tumor barrier, BBTB)という腫瘍部位に近接して存在する別の関門があります」。現在森尾助教は、BBBモデル構築で得た知見を活かし、ヒトin vitro BBTBモデルの開発にも取り組んでいる。完成すれば、BBTBを突破する薬物や技術の開発に大きく寄与するものになる。

脳の腫瘍に薬剤を届ける新しい細胞医薬の開発
森尾助教は、腫瘍部位にアクセスできる細胞の特性を活かした、新規のグリオーマ治療法の開発にも挑んでいる。
注目するのが、ペリサイトだ。「ペリサイトには、腫瘍付近に豊富に存在する血管に寄っていく性質(指向性)があることに加え、BBB透過能を持つ間葉系幹細胞とも似た性質を持っています。この性質から、治療薬を脳外から脳内の腫瘍部位へ的確にグリオーマへ送達する細胞医薬として、ペリサイトを活用できるのではないかと考えました」
マウスを用いた実験では、ペリサイトがグリオーマ付近にアクセスできる可能性が報告されている。森尾助教の実験でも、アストロサイトとグリオーマ細胞それぞれから構成される細胞塊にペリサイトを播種すると、アストロサイトの細胞塊に対しては表面に少し付着するだけだが、グリオーマ細胞に対してはより多くのぺりサイトが内部にまで侵入していく様子が観察された。
「また、トランスウェル上面にペリサイト、プレート底面にアストロサイトあるいは3種類グリオーマ細胞を1種ずつ播種して共培養したところ、ペリサイトはアストロサイトに対する指向性はほとんど示さなかった一方で、グリオーマに対しては、トランススウェルを突破して近づいていく様子が観察され、ペリサイトが腫瘍部へ高い指向性を示す可能性が示唆されました」
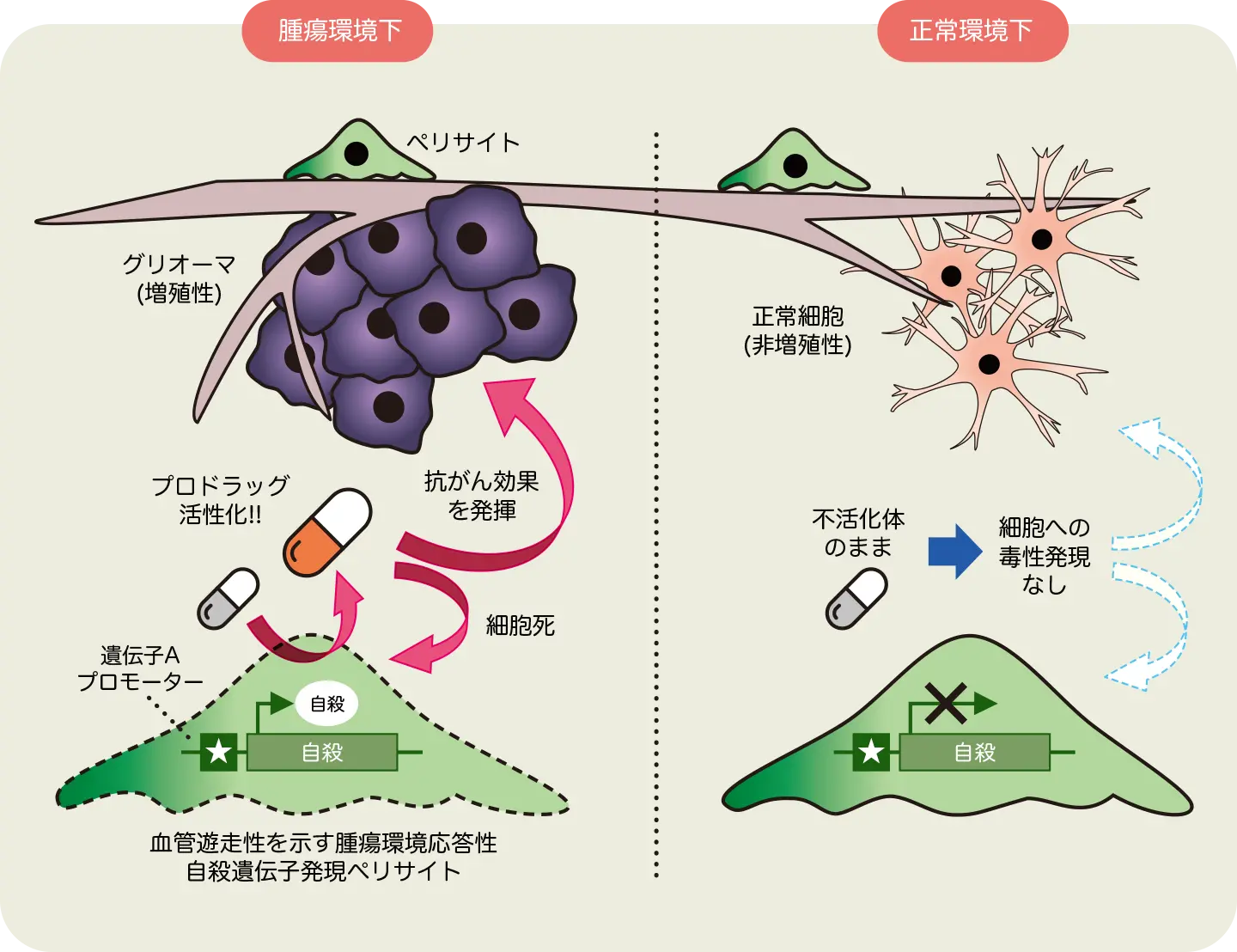
一方、ペリサイトに搭載する治療法候補を探索し、目をつけたのが、自殺遺伝子療法である。自殺遺伝子療法とは、目的の細胞に自殺遺伝子を発現させることで、その細胞と周りの増殖性細胞にまで毒性を波及させ、高い抗がん効果を発揮するものだ。「この自殺遺伝子療法とペリサイトを組み合わせることによって、腫瘍血管および腫瘍部位へとアクセスし、抗がん効果を発揮させる、これまでにないグリオーマ治療法を開発しようと考えています」
それに加えて、グリオーマと共培養した時に顕著に発現が誘導されるペリサイトの遺伝子を同定。この遺伝子のプロモーターを自殺遺伝子の上流に導入することで、腫瘍が存在する環境でしか自殺遺伝子による抗がん効果が発現しない、より安全性の高い治療法の確立を目指す。
全身の臓器のモデルを構築し創薬の発展に貢献する
現在森尾助教は、3Dモデル階層型スフェロイドの構築技術を応用し、脳だけでなく全身の臓器の模倣モデルを開発することにも挑もうとしている。最初のターゲットに据えるのが、肝臓だ。肝臓は、肝類洞内皮細胞を主体とする類洞と呼ばれる血管構造を持っている。脳の場合と同様に、ヒト不死化肝細胞を中心にして、ヒト不死化肝星細胞、そしてヒト不死化肝類洞内皮細胞の順に階層したスフェロイド型モデルを構築しようとしている。
「創薬の途中で中止を余儀なくされる原因として最も多いもののひとつが、肝毒性です。ヒトにおける薬物動態や毒性発現を予測できる肝臓モデルがあれば、開発の初期段階で毒性を予測し、時間・金銭的なロスを防ぎながら効率良く創薬プロセスを進めていくことができます」と言う。肝臓を出発点に、他の臓器のモデル化も進める。「階層型スフェロイド構築技術で、日本・世界の創薬の発展を後押していきたい」と大きな展望を描いている。