薬の効果を最大限に発揮させるための製剤設計研究
医薬品開発の創薬段階において、数多くある候補分子の中から有効な化合物が創出される。一般に原薬単独で身体に投与されることはほとんどなく、医薬品として完成させるには、最適な形に製剤するプロセスが不可欠である。如何にして体のバリア機能を突破し必要量の薬を体内の適所に届けることができるか、どのような投与形態がベストであるかを考え形にするのが製剤設計である。薬効を損なわないことはもちろん、有効成分を患部に届けるシステムを構築したり、副作用を少なくする工夫も必要である。さらには精神的・身体的な苦痛を伴わず(低侵襲性)、服用しやすいことも望まれる。高島由季准教授は、そうした創薬のための製剤設計やDDS(Drug Delivery System)を研究している。とりわけがんや免疫疾患、難治性眼科疾患、感染症、脳神経系疾患など、いまだに有効な治療法が確立されていないアンメットメディカルニーズに応える創薬に貢献するのが目標である。
「創薬の現場では今、溶けにくく、体に吸収されにくい難溶性・難吸収性の薬物が増えており、その製剤設計が課題になっています」。そう現状を語る高島准教授の研究グループは、特に薬物をナノサイズに微小化するナノ粒子化の技術に優れ、数々の新規機能性ナノ粒子の調製に成功してきた。
点眼で薬を網膜にまで届ける画期的な製剤の開発に向けて
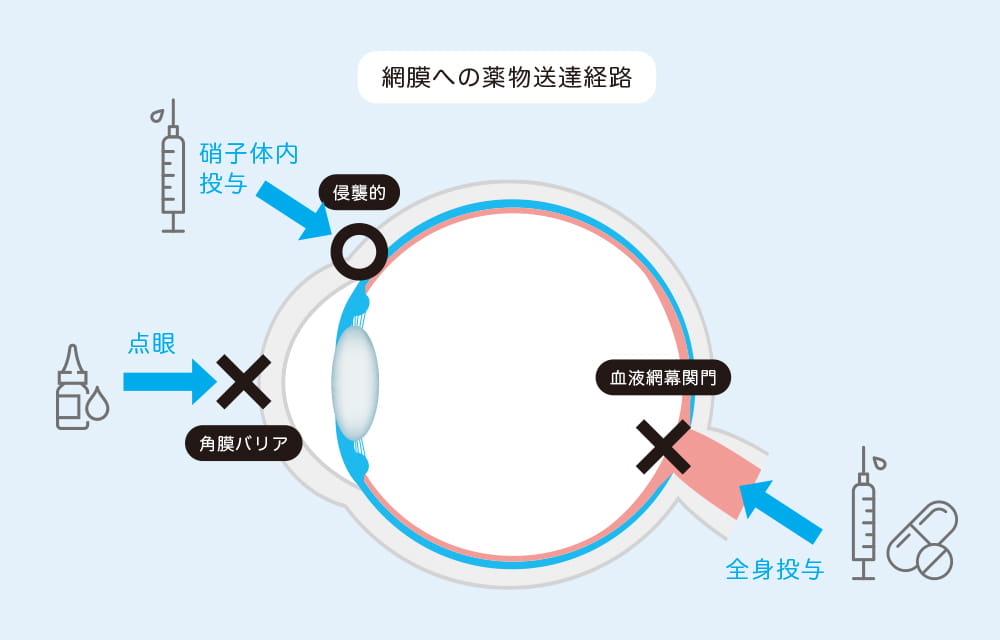
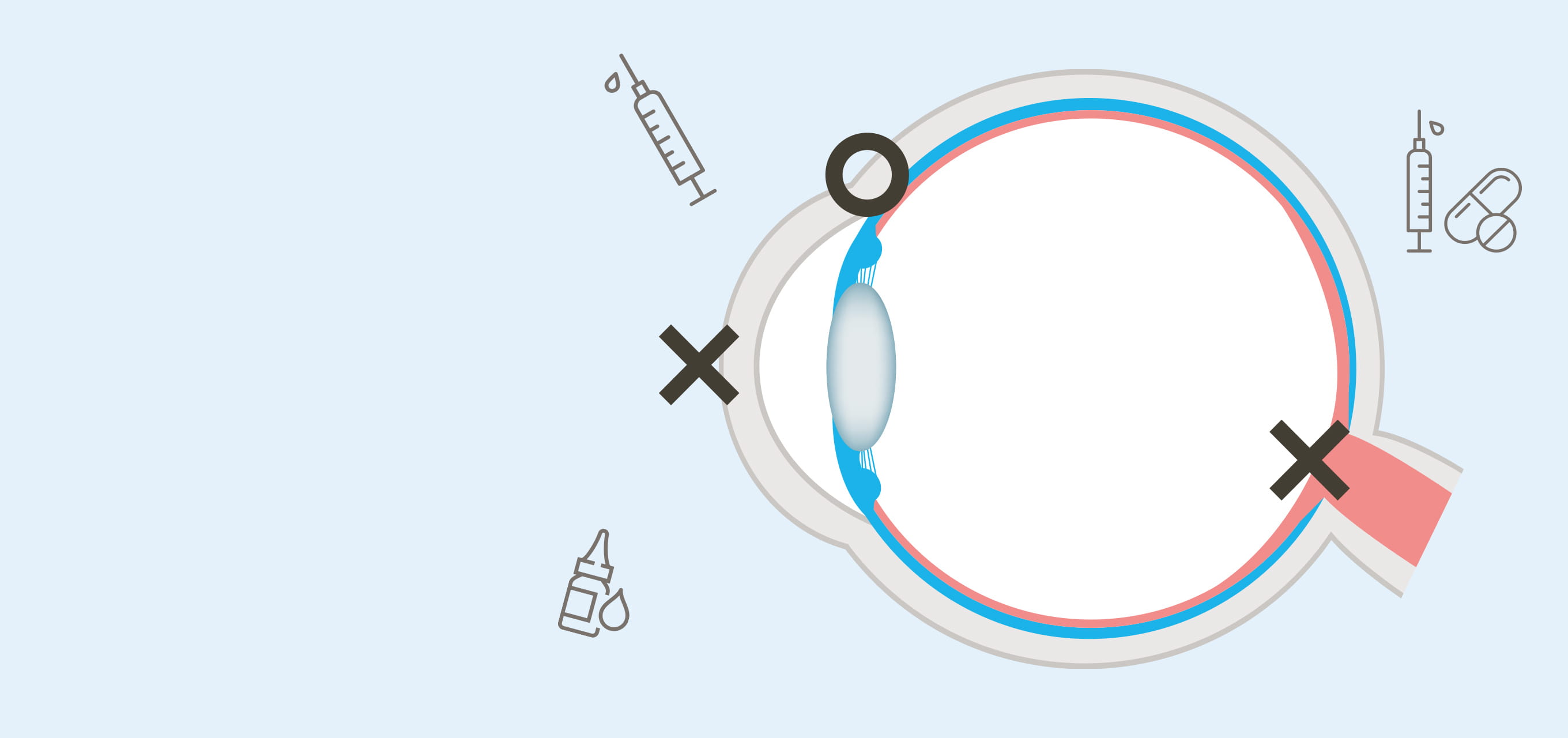
高島准教授の近年の画期的な成果の一つに、網膜に薬成分を届ける点眼技術の開発がある。「眼は外界と接しているため、外から異物が侵入したり、体内の成分が眼内に流入しないよう高度なバリア機能を備えています。ところが薬を送り込む上ではこの防御機構が大きな障壁になります」と高島准教授は解説する。
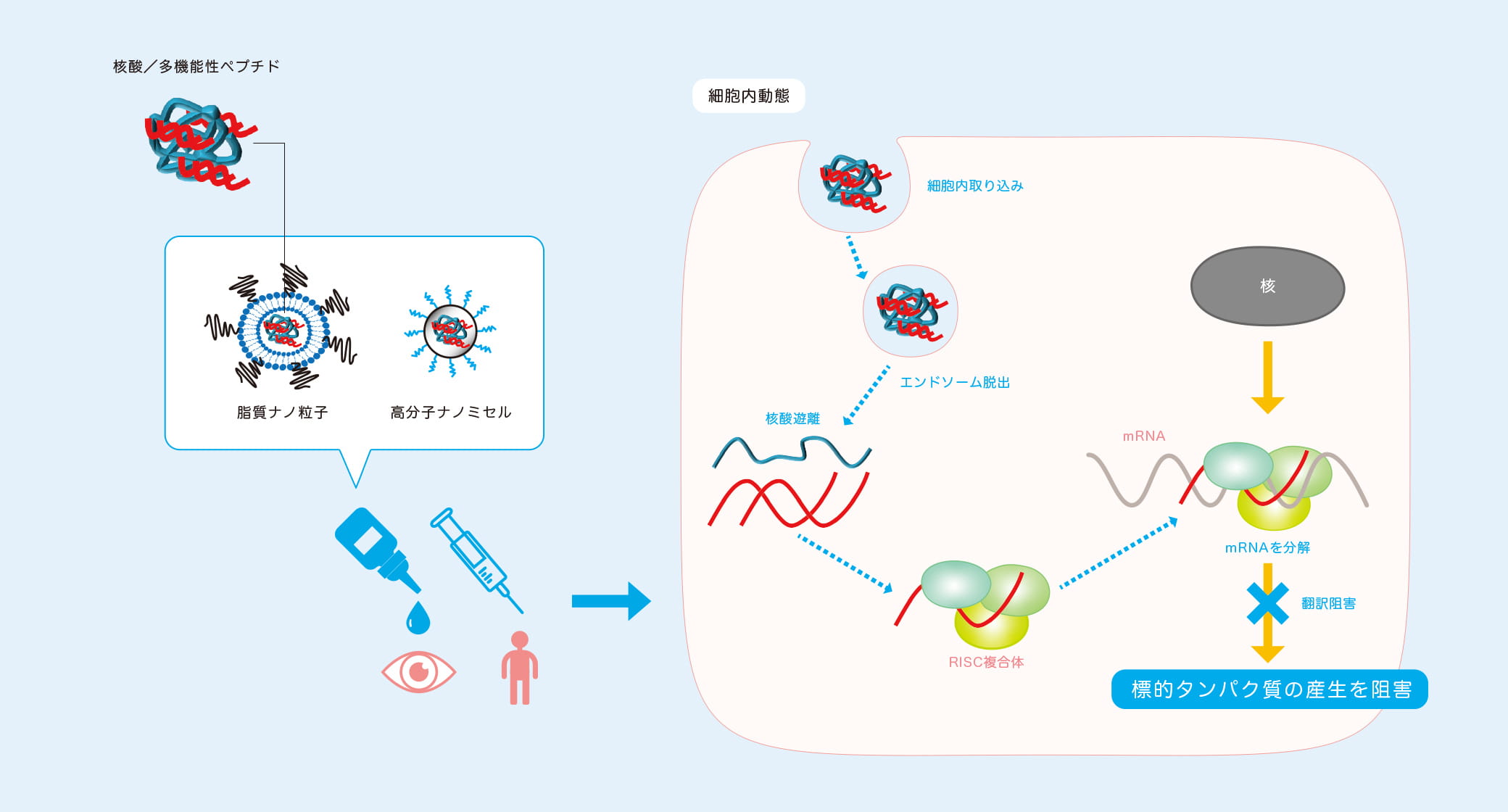
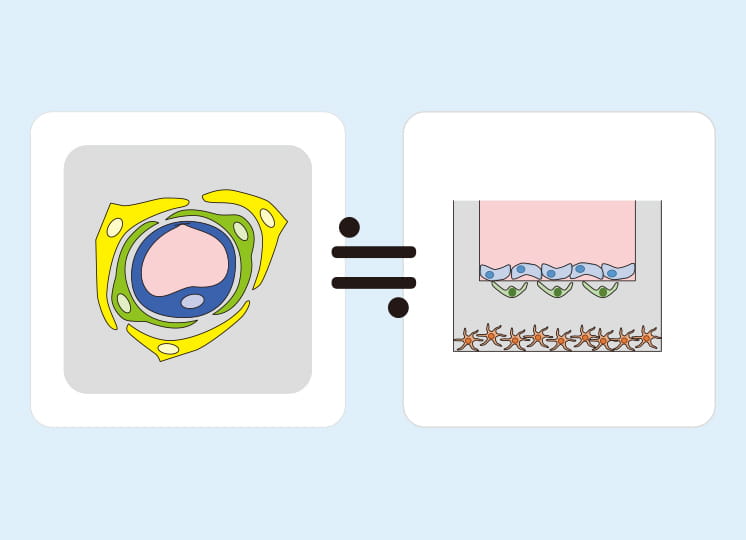
網膜は、我々がモノの形や色、明暗を認識するための大切な器官であり、眼球内に異物や血液成分が流入すると視力低下につながる。このため、前眼部には角膜バリアと脈絡膜血管から血漿成分や高分子量の親水性物質が眼内に漏れ出るのを防ぐ血液房水関門(BAB)があり、その奥の後眼部に全身血流から物質が流出するのを防ぐ血液網膜関門(BRB)が存在する。「点眼薬ではこれらの関門を突破して網膜にまで薬を届けることができないため、眼球に注射針を挿入して直接薬を注入するか、レーザー照射や手術を施すしかありません。こうした方法は患者にとって精神的、身体的、経済的負担が極めて大きいため、より低侵襲で簡便な治療薬の開発が待たれています」と高島准教授は解説する。そこで高島准教授らが開発を進めているのが、治療薬の核酸をリポソーム等の脂質ナノ粒子に封入し、低侵襲的な点眼で網膜に届ける新しいDDS 製剤である。
リポソームは、細胞膜や生体膜を構成するリン脂質からなる人工の微小カプセルで、生体適合性が高いことから体内で薬を送達するキャリア(輸送体)としてよく用いられる。高島准教授らは、この微小リポソームのカプセルに網膜疾患の原因となる血管の新生を抑える核酸を封入。カプセルの表面には、網膜にある受容体と結合するトランスフェリンや網膜色素上皮層(RPE)に結合して内在化するモノクローナル抗体を修飾し、標的である網膜に留まりやすいよう工夫を施した。また、カプセルは直径約70nm以下に微小化。網膜と周囲の血管の間にある直径約80nmの小孔を通り抜けられるサイズにするためだ。「実証実験で作製した脂質ナノ粒子をラットに点眼したところ、後眼部の網膜にしっかり留まることを確かめました」。
超高齢化社会に突入し眼疾患の罹患率は増加傾向にある。日本でも加齢黄斑変性症や糖尿病網膜症、網膜色素変性症といった中途失明に至る網膜関連の疾患が増えている。高島准教授らの研究成果はこうした網膜疾患の新たな治療薬の開発につながることが期待される。
全身のがん細胞へ、脳へ、困難な製剤設計を可能にする
高島准教授らは、リポソームと並んで有用なDDSキャリアとして知られる高分子ミセルと研究室で独自開発した多機能性ペプチドを組み合わせたナノキャリアを設計し、体の適所に薬物を届けることも可能にしている。高分子ミセルは、生体親和性や生分解性、血中での安定性に優れていることに加え、粒子サイズを調整しやすいといった特長がある。網膜と同じく、高度なバリア機能として知られる血液脳関門の存在は脳への薬物送達を困難にする。このナノキャリアは低侵襲的な経鼻投与のルートで脳へ薬物を送り届けることができ、脳神経疾患治療への応用も期待される。
准教授が現在企業や他大学との共同研究で開発を進めているのが、がんや関節リウマチなど治療薬に用いるDDSキャリアだ。「理想的な形は、低侵襲的な投与形態であること、血中などの体内では安定に滞留すること、正常組織や細胞には届かず、がん細胞や炎症を起こしている標的の組織や細胞に選択的に到達すること、標的部位で治療効果が発揮されるようにすることです。DDSキャリアは体内では異物として認識されるため、標的組織へ薬を届けるためには、細網内皮系による食作用や細胞内での分解作用など体内の様々なバリア機能による排除を回避する必要があります。高分子ミセルは血流での安定性が高く異物として排除されることを防ぐことができます。また、核酸は細胞質内で効果を発揮するため、標的部位に到達した後に細胞膜を突破させる必要があります。私たちは、細胞膜を透過する機能を持ち静電的相互作用により核酸と複合体ナノ粒子を形成するアルギニンや細胞内に取り込まれた後に分解に寄与するエンドソームからの遊離を促すヒスチジンなどの塩基性アミノ酸に加え、血流内では薬である核酸をしっかり保持し、細胞内の酸性環境下に入るとうまく解列する働きをするシステインから成る多機能ペプチドを合成しました。この多機能性ペプチドを高分子ミセルに組み込むことで、体内動態に加え細胞内動態もコントロール可能なDDSキャリアとなり、核酸薬治療への応用が期待できます」と高島准教授。共同研究チームではキャリアの組成から調製プロセスについても検討し、病気の原因となる新生血管や炎症性サイトカインなどの産生を遺伝子レベルで抑える核酸を薬として有効に腫瘍や関節リウマチの炎症部位に作用させることに成功している。このキャリアは、核酸を混合するだけで投与できる簡便な形に設計しているため、疾患に応じて様々な核酸が搭載可能である。