基底膜の主成分であるラミニン-511を世界で初めて同定
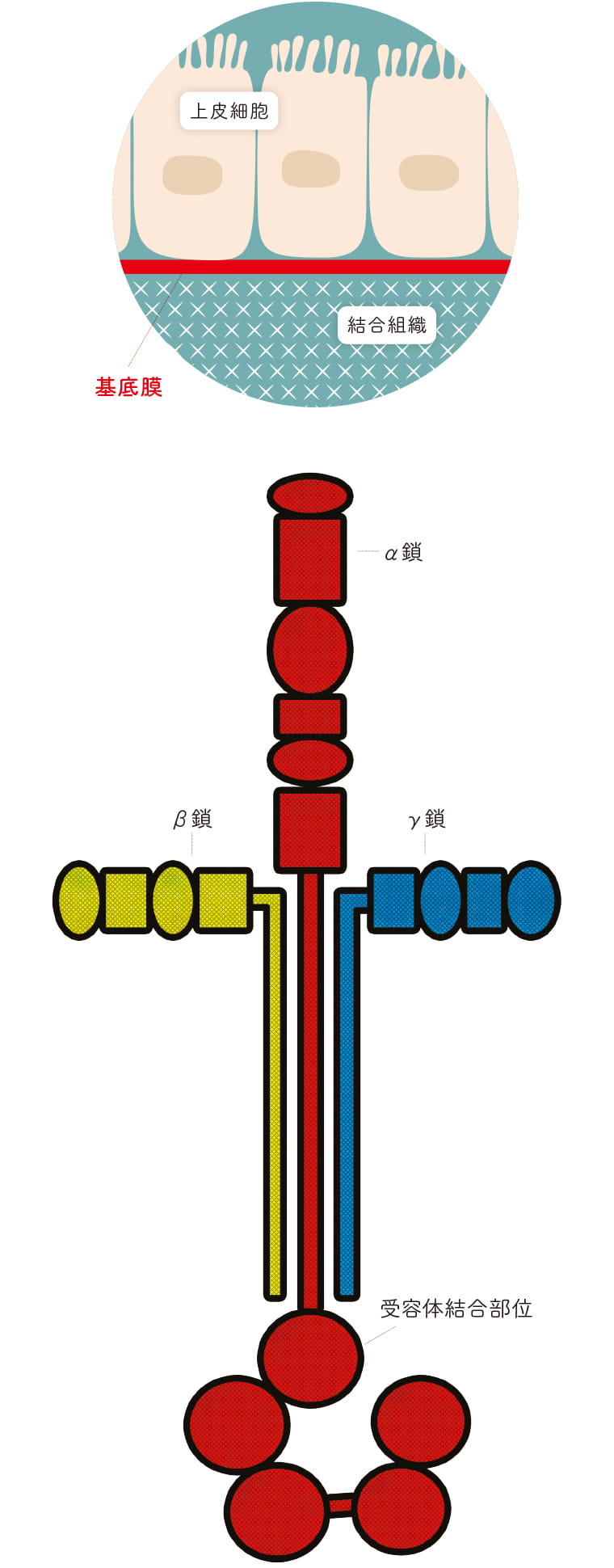
体表面や臓器は皮膚や粘膜などの上皮に覆われている。より詳細に見ると、上皮細胞と間充織の間には、細胞外マトリックスからなる基底膜と呼ばれる巨大なタンパク質の膜がある。基底膜は、厚さ50nmほどの薄膜状の構造体で、組織を安定させ、組織の形態を保つ役割を果たしている。この基底膜の主要な構成分子の一つ・ラミニン-511を世界で初めて同定したのが、吉川大和准教授である。
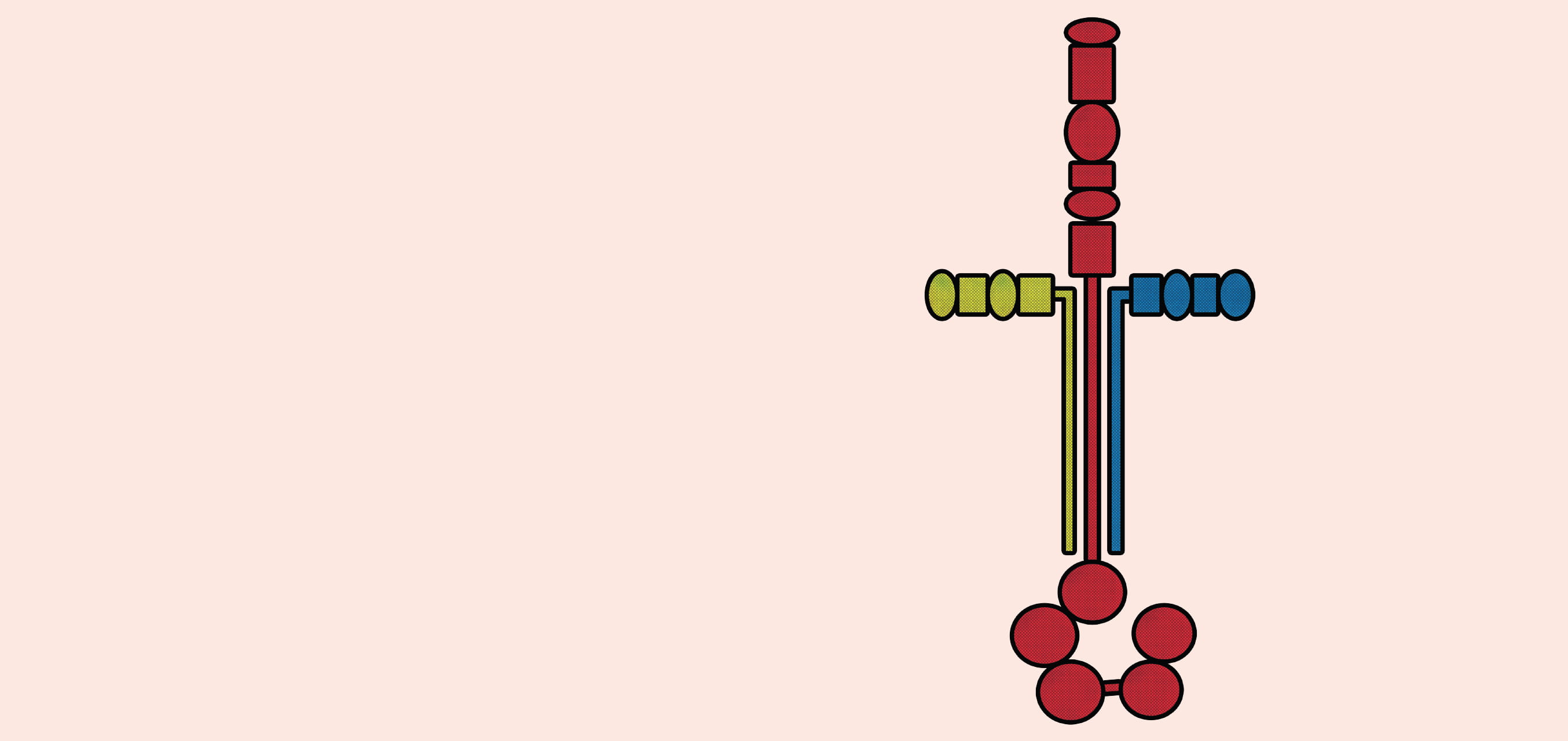
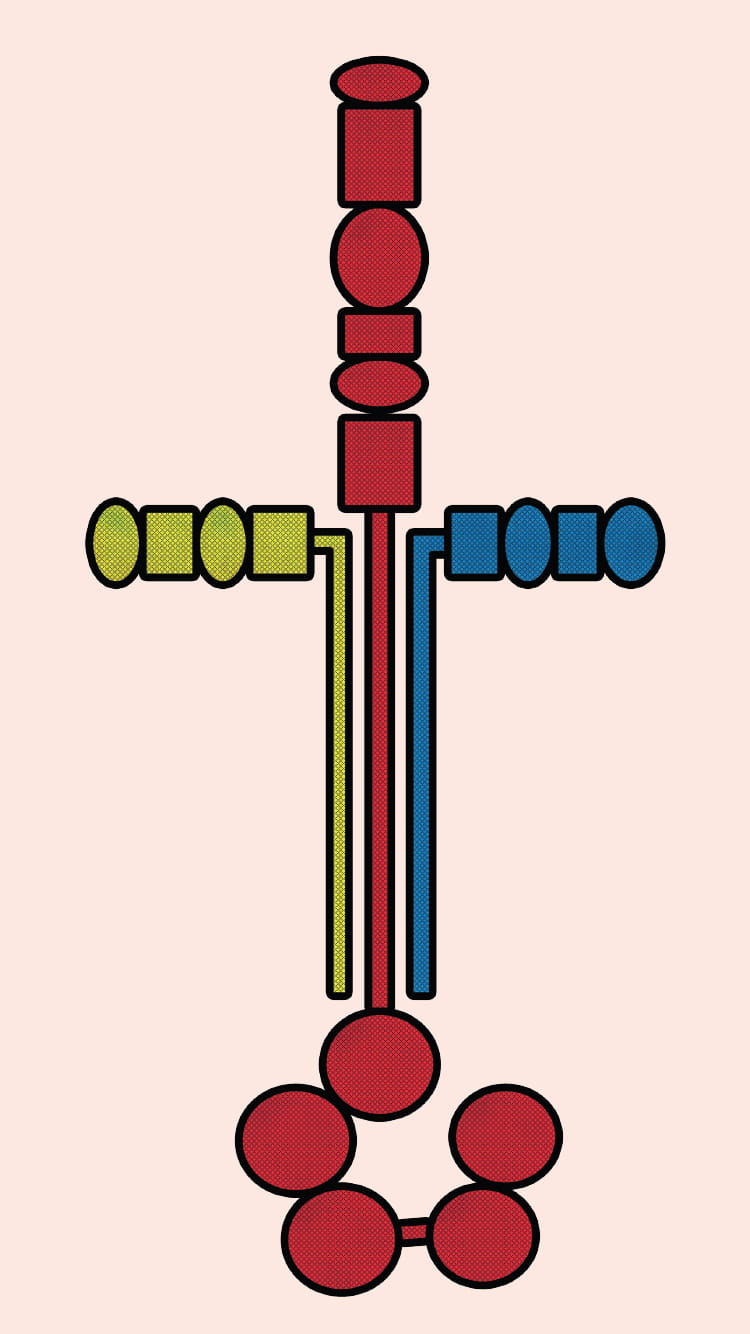
「ラミニンはα、β、γの3つの遺伝子の鎖からなるヘテロ三量体で、分子量が50~90万にもなる巨大な分子です。独特の十字架のような構造を持っているのが特徴で、α鎖、β鎖、γ鎖はそれぞれ5種類、3種類、3種類あり、その組み合わせによって19種類のラミニンファミリーが存在します」。そう解説した吉川准教授は、ラミニンに、他の細胞外マトリックスには見られない強力な細胞接着活性と、それに相反する運動促進活性があることを明らかにし、このユニークなタンパク質に注目が集まるきっかけを作った。しかし受容体結合や基底膜形成のメカニズムなど、いまだ不明な部分は少なくない。吉川准教授は、ラミニンの機能や受容体、基底膜の形成、それに関わる病態のメカニズムを解明し、創薬や再生医療などへの応用可能性を探っている。
ラミニンや受容体の機能を解明し
抗体医薬の創製につなげる
これまでに肝臓におけるラミニンの役割に関して画期的な研究成果を挙げてきた。肝臓が欠損した際、残った部分が増殖して元に戻る肝再生や、胎児の肝臓の胆管形成にラミニンが関与していることを見出したのもその一つだ。またヒトの肝細胞がんの組織も検討し、ラミニンα5鎖、β1鎖、γ1鎖からなるラミニン-511が細胞接着と伸展を促進することで、肝細胞内への浸潤に関与していることを突き止めた。さらにラミニンα5鎖に特異的に結合する受容体・ルテランの結合部位の同定にも成功。肝細胞がんにおいて、ラミニン-511がルテランと結合して細胞接着を抑制する様子を観察し、ラミニン-511が細胞運動を制御するメカニズムを明らかにした。
がんの転移や浸潤におけるラミニンや受容体の役割の解明は、抗体医薬の開発につながる。抗体医薬は、がん細胞などの抗原にピンポイントで送達されるため、高い治療効果が期待されている次世代の医薬品だ。吉川准教授は、ヒト型組換え抗体の利点を生かし、細胞障害活性のある薬物を結合させた、抗体-薬物結合体の作製に取り組んでいる。最近の研究で、抗ルテラン・ヒト型組換え抗体にジフテリア毒素や抗がん剤を結合させ、抗がん作用を付加することに成功した。
「抗体は細胞表面にある抗原と結合しますが、抗がん剤の多くは細胞内で障害作用を示します。そのため抗体-薬物結合体をがん細胞に届けただけでは薬効を発揮できないのが難点です。そのため細胞内に内在化する抗原を見つける必要があります」と吉川准教授。まず細胞表面分子であるルテランが、ヒト乳がん組織や乳がん細胞株で強く発現することを観察。一方で、ジフテリア毒素を結合させたマウス抗ルテラン抗体が細胞に内在化され、ジフテリア毒素によってがん細胞の増殖を抑制することを見出した。「この結果をもとに、抗原とともに細胞に内在化され、がん細胞増殖抑制剤として有望な新規のヒト由来の抗ルテラン組換え抗体を作製しました」。乳がんに対する新たな抗体医薬の創製につながる大きな成果となった。
基底膜関連疾患の解明や培養基質の開発に応用
現在は、基底膜が関わる疾患の一つである先天性ネフローゼ症候群に着目し、ラミニンの役割やそのメカニズムの解明に力を注いでいる。ネフローゼ症候群は、尿にタンパクが多量に漏れ出ることによって血液中のタンパク濃度が低下し、むくみ(浮腫)が起こる疾患である。「腎臓には毛細血管が集まった糸球体があり、その中の基底膜に含まれるラミニンβ2鎖が血液をろ過するフィルターとして働いています。このラミニンβ2鎖が欠損し、ろ過機能が破綻するのがネフローゼの一つピアソン症候群です」と吉川准教授。ピアソン症候群の腎臓の細胞にラミニンβ2鎖を投与し、若干だが病態が改善することを確かめている。その分子メカニズムを解明できれば、いずれネフローゼ症候群の治療薬を開発することも可能になるかもしれない。
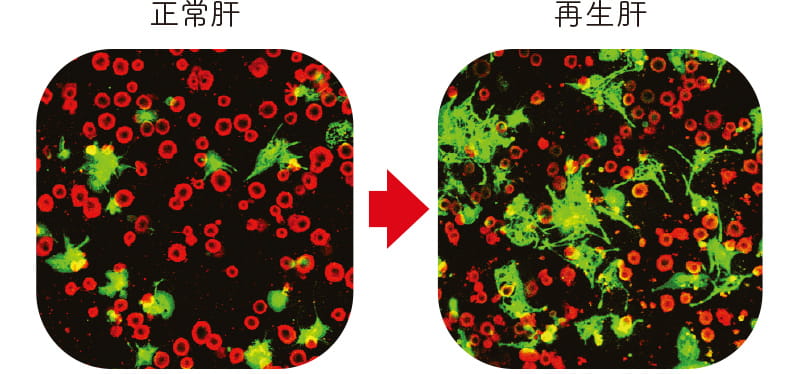
Sinusoidal endothelial cells (緑、類同内皮細胞)
加えて「ラミニンには、バイオマテリアルとしての可能性もあります」と語った吉川准教授は、ラミニンの培養基質への応用も進めている。「幹細胞の培養では一般的に細胞を分化・増殖を補助するフィーダー細胞が用いられますが、その場合、作業工程が多くなるという課題があります。しかし培養基質にラミニン-511を使うと、フィーダー細胞を用いなくても細胞を安定して継代培養できます」と言う。吉川准教授が世界に先駆けて精製したラミニン-511は、iPS細胞のスタンダードな培養基質の開発につながったことでも知られている。現在はラミニン-511に関する豊富な知見をもとに、人工基底膜や3Dscaffold(細胞培養基材)などの組織形成に用いる培養基質の開発を進めている。いずれ製品化し、再生医療の進展に寄与することを目指している。