ヒトの「死なない」血液脳関門細胞を開発
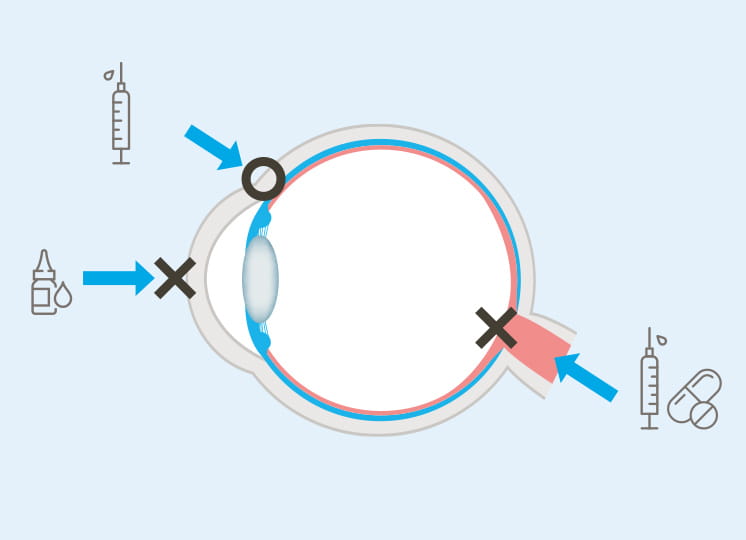
生命にとって最も重要な器官である脳は、その高度な機能を守るため、血液脳関門(bloodbrain barrier, BBB)などの強固なバリア機能を備えている。しかしこの防御壁は、異物の侵入を防ぐだけでなく、脳に薬を送り届けるのも阻むため、これまで脳疾患の治療薬の開発は難しいとされてきた。この課題の解決に役立つ革新的な成果として、降幡知巳教授は、BBBの働きを再現するミクロサイズのヒト脳を開発し、世界に大きな驚きを与えている。
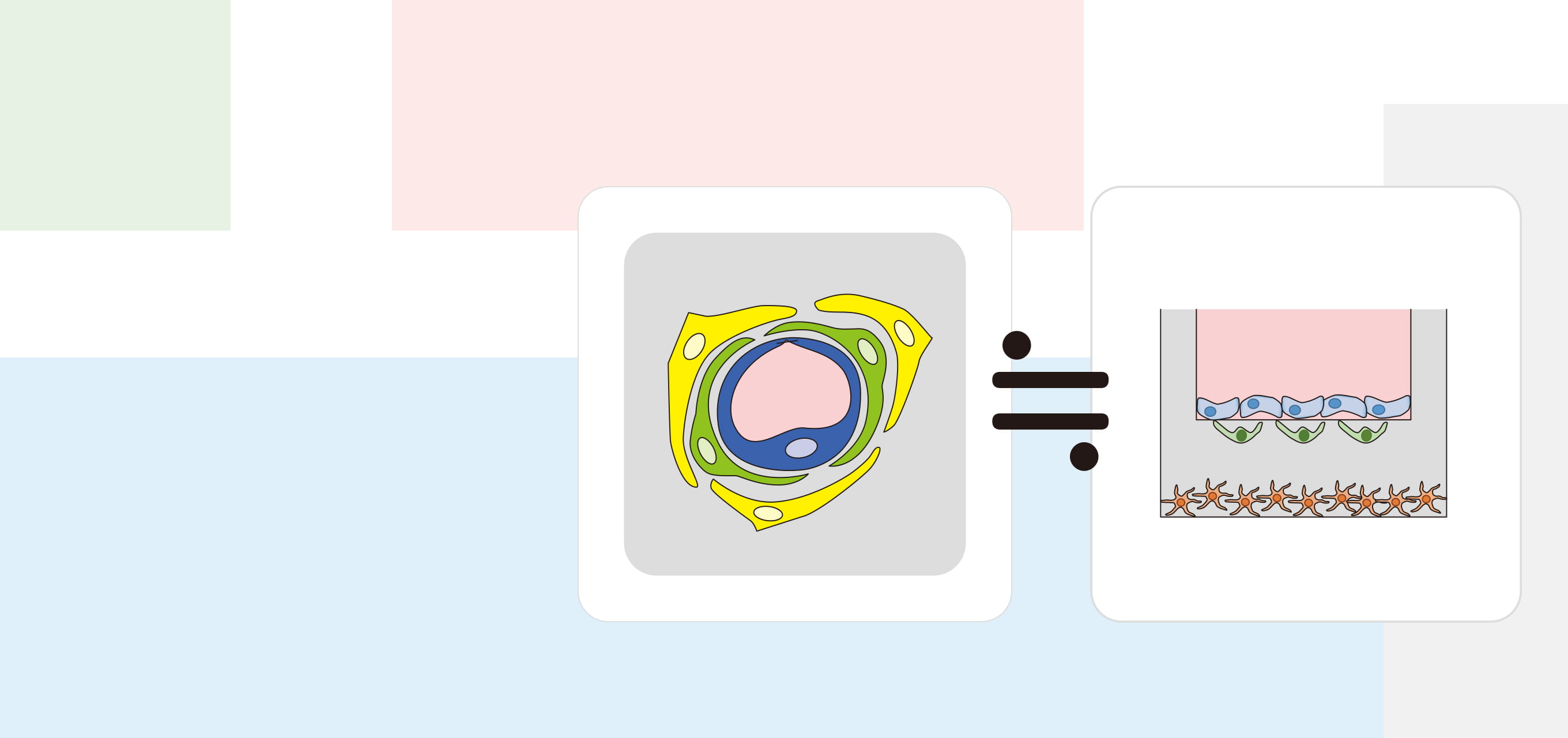
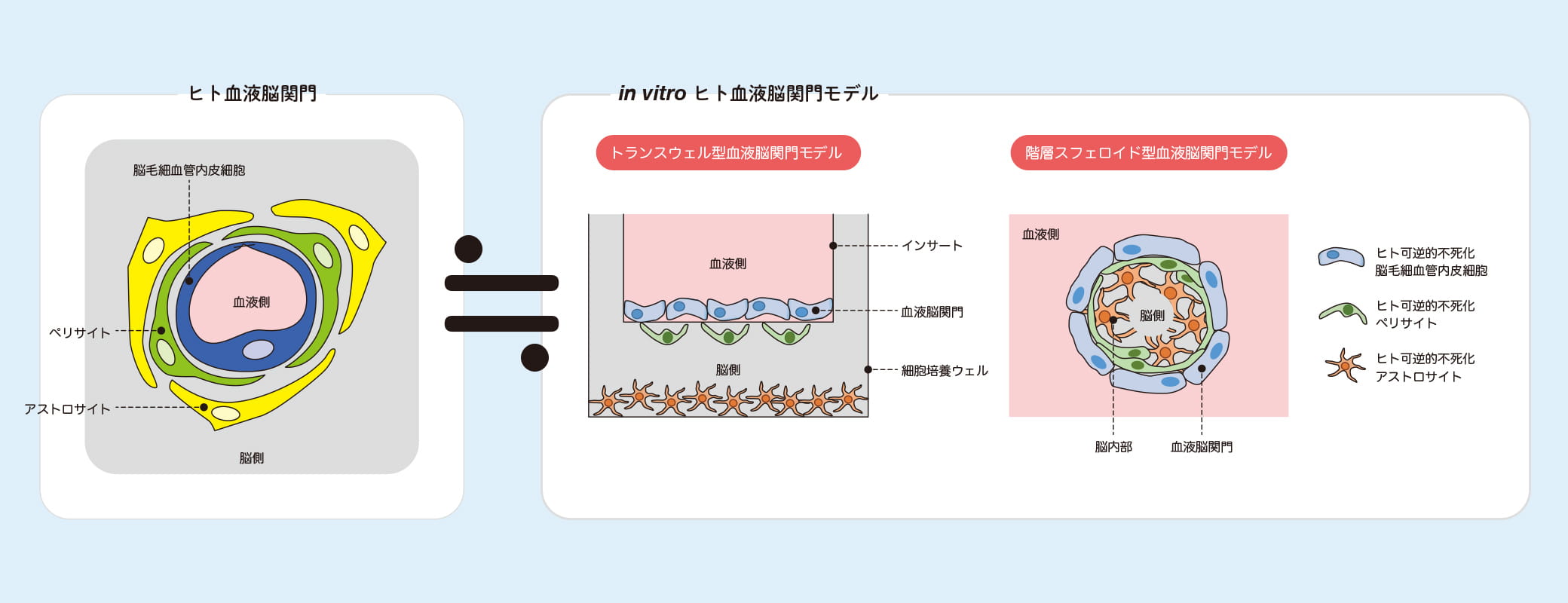
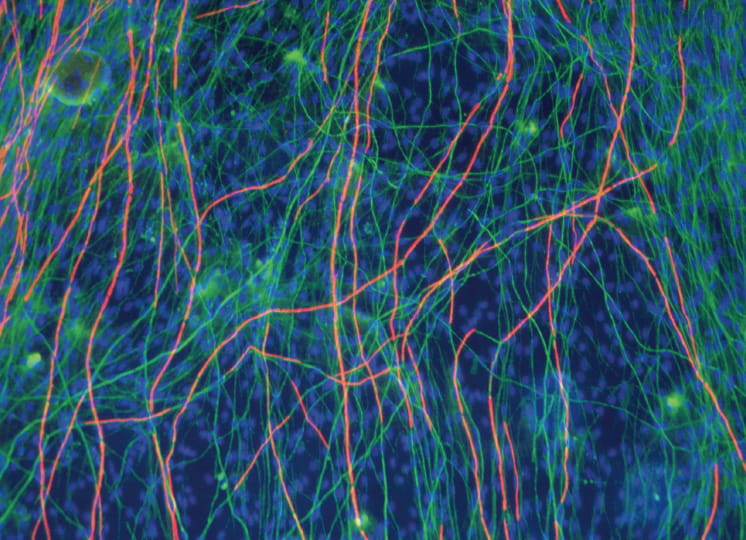
「血液脳関門(BBB)は、脳毛細血管内皮細胞からなり、その周りをペリサイトとアストロサイトが覆う独特の構造を持っています。これまで初代培養細胞を使ったBBBモデルが構築された例はありますが、ヒトのBBB 機能を反映し、かつ創薬で使えるほど簡便で大量に構築することができるモデルはありませんでした」と降幡教授は解説する。
一般に試験管(in vitro)での実験試料には生体機能を最も保持している初代培養細胞が使われるが、動物とは種差の問題があり、ヒト初代培養細胞は希少で実験のために大量に確保するのは難しい。そこで降幡教授が着目したのが、可逆的不死化細胞だ。不死化細胞とは、文字通り「死なない」細胞で、由来細胞の機能を保持しながら長期間にわたって細胞分裂を繰り返し、無限に増殖する。
しかしヒト不死化細胞を作るのは簡単ではない。動物の場合は、不死化遺伝子を導入したマウスなどから不死化細胞を樹立できるが、ヒトには動物と異なる細胞老化機構が備わっていて、 不死化しにくいため、この方法を適用できないからだ。
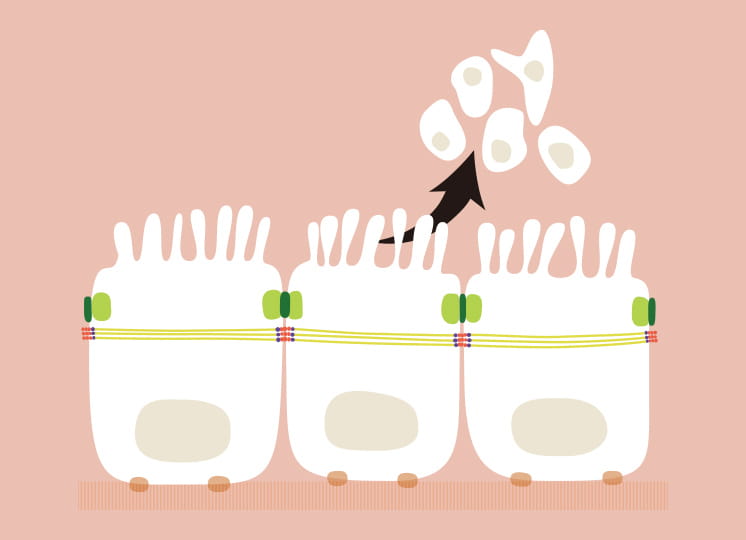
降幡教授は、ヒト初代培養細胞に不死化遺伝子を導入し、BBBの実体であるヒト不死化脳毛細血管内皮細胞を樹立する独自の手法を開発。同様にヒトペリサイト、ヒトアストロサイトの不死化も実現した。ここで着目したいのが不死化の可逆性だ。「一般に、分裂している細胞と、十分な大きさ・形に成熟した細胞の機能は異なります。つまり不死化細胞は増殖しているうちは、由来細胞の本来の機能を十分に発揮できないわけです。そこで私たちは、温度をトリガーとして不死化シグナルを解除する不死化遺伝子を初代培養細胞に導入しました。これにより樹立したヒト可逆的不死化細胞は、通常は絶えず増殖し続けますが、ある温度条件を与えると不死化シグナルが解除されて細胞分裂を止め、元に戻って細胞本来の機能を発現します。この温度を用いる方法は私達オリジナルの技術ではありません。しかし、単なる不死化細胞ではなく、高機能な可逆的ヒト不死化細胞を作成できるところに、私達の強みがあります」。降幡教授は、世界最高水準のヒト不死化細胞を作成できる世界でも一握りの研究者なのだ。