新たな創薬モダリティの課題は消化管での吸収性
医薬品開発において、薬効のみならず、その薬が体内でどのように吸収・分布・代謝されて、最終的に排泄されるのか、薬物動態を知ることも極めて重要である。中でも予測が難しいといわれているのが、消化管での「吸収性」だ。近年、従来の低分子医薬品に取って代わって、分子サイズの大きいバイオ医薬品や中分子医薬品が創薬モダリティの新たな潮流となる中で、「薬をいかに吸収させるか」が課題となっており、吸収性のメカニズムを解明する重要性はますます大きくなっている。井上勝央教授は、腸管での生体膜透過に着目して薬物吸収メカニズムを分子レベルで解き明かし、創薬へ応用することを目指している。
なぜ腸管吸収を予測することがそれほど難しいのか。井上教授はこう説明する。「理由の一つは、腸管の吸収経路が複雑なことです。腸管に入ってきた薬物は、腸管の上皮細胞を通過した後、血管を通って肝臓に届き、そこでの代謝を潜り抜けて初めて体循環に移行、効果を発揮します。吸収経路が何段階にも及び、個々のプロセスが薬物の吸収へどのような影響を及ぼすのかを生体レベルで観測・予測することは困難です。もう一つには、研究の難しさも挙げられます。ヒトと種々の動物では、薬物が体循環にまで到達する指標であるバイオアベイラビリティが異なるため、実験動物を用いた試験でヒトの腸管吸収を予測することは困難です」。井上教授は、最先端の分子生物学的手法を駆使し、この難関の攻略に挑んでいる。
粘膜層を構成するムチンを解析し
薬物吸収制御の仕組みを追求
腸管での生体膜透過過程には、単純拡散だけでなく、トランスポーターや代謝酵素、腸内細菌、脂質二重膜、粘膜層などさまざまな要素が関わっていると考えられている。全体像の解明に向け、井上教授は粘膜層の重要性にも注目している。「体外から取り込まれる物質と直に接する消化管は、外敵から生体を守るため、腸管上皮表面に粘膜層のバリアを形成しています。最近の創薬トレンドとして、中分子医薬品の経口投与剤の開発が盛んになっていますが、その際の薬剤の腸管吸収を阻む要因としても粘膜層が課題になっています」
井上教授によると、粘液の主成分である糖タンパク質のムチンが網目状の分子ネットワークを形成し、水分を保持することで粘膜層がつくられている。これまでに約20種類のヒトのムチン分子が同定されており、消化管では約13種類の発現が認められているという。井上教授らは、ラットの腸管を使って十二指腸部、空腸部、回腸部、結腸部それぞれの粘膜層について、薬物透過性に対する影響評価を行い、ムチン分子が薬物の腸管膜透過性を制御する重要な因子の一つである可能性を突き止めた。さらにヒトの消化管で発現が確認されている13種類のムチン各々の分子の特性を精査し、粘膜層の薬物吸収制御メカニズムを解明しようと試みている。
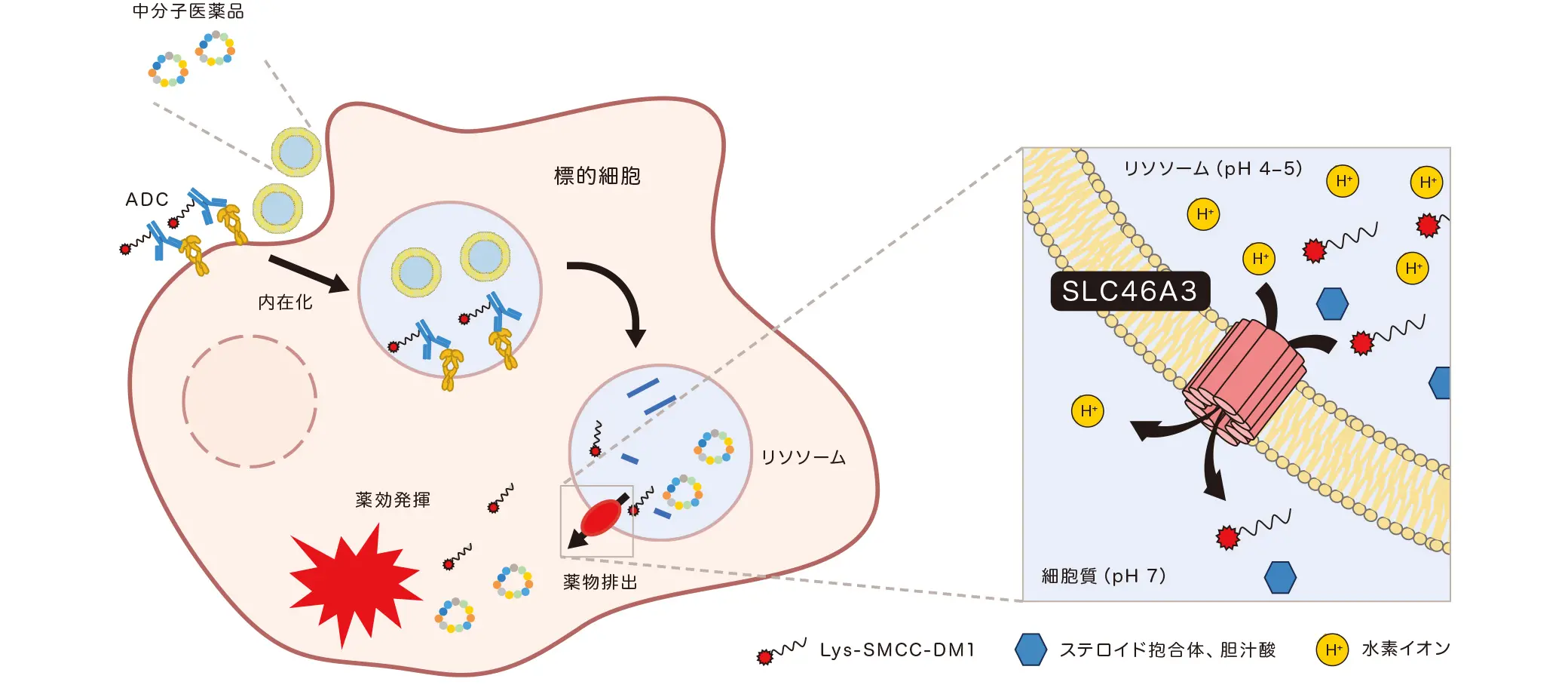
リソソームから薬物を取り出す輸送体を世界で初めて発見
また井上教授は、腸管上皮細胞膜に局在し、薬物輸送に関わるトランスポーターの究明にも取り組んでいる。「腸管の管腔側から上皮細胞内へ薬物が入るところに関わるトランスポーターは、世界的な研究でほぼすべて同定されています。しかし上皮細胞内から血液側へ薬物を移行する、いわば『出口』に関わる分子機構についてはほとんどわかっていません」と言う。井上教授らは、この上皮細胞の出口側にあたる側底膜に局在するトランスポーターを探索。いくつかの分子の同定に成功している。
こうした生体膜透過に関わる研究知見を生かした最新の研究では、細胞内のリソソームから化合物を取り出すトランスポーターを世界で初めて発見し、反響を呼んだ。
「近年開発が進む抗体-薬物複合体(ADC)は、分子サイズの大きさから生体膜透過性が低いため、抗体や特殊なキャリアを利用して標的細胞に送達し、エンドサイトーシスという機構によって細胞内に取り込まれます。細胞内に取り込まれたADCはリソソーム内で分解され、ADCから遊離された薬物が細胞質へ移行することで、ようやく薬効を発揮できます。しかしここでも生体膜(リソソーム膜)が薬物の透過を阻む壁になります」と研究背景を語る。井上教授らの研究グループは、リソソーム内のステロイド抱合体や胆汁酸などの有機アニオン化合物を細胞質内に輸送するトランスポーターとして、世界で初めてリソソーム膜タンパク質SLC46A3を同定した。それと同時にSLC46A3が、有機アニオン化合物だけでなく、乳がん治療に用いられるADCの一つトラスツズマブエムタンシン(T-DM1)の活性代謝物も細胞質へ移送することも見出した。
リソソーム内にある分子の「出口」に関する知見はほとんどない中にあって、井上教授の研究成果は、リソソームから多様な化合物を「取り出す」分子機構の存在を明らかにするとともに、そこにSLC46A3が関与する可能性を示したことになる。さまざまな化合物をリソソームから容易に取り出せるようになれば、生体膜透過が難しいADCや中分子医薬品など、より有効な新規創薬モダリティの開発に役立つに違いない。井上教授のさらなる研究に期待がかかる。







