免疫細胞による破壊と再生で健康は保たれている
ヒトは、病原体などから身体を守る「免疫」という防御機構を備えている。免疫細胞は、細菌やウイルス、がん細胞といった身体にとって危険なものを排除する一方で、自分の身体を構成する細胞や栄養になる食べ物には応答しない。自己と非自己を識別し、非自己を排除する。その絶妙なバランスによって寛容を保つことで、健康を守っているのだ。
浅野謙一准教授は、こうした免疫バランスを制御し、病気の予防や治療に役立てる研究に取り組んでいる。特に関心を持っているのが、単球・マクロファージの持つ相反する二つの機能だ。
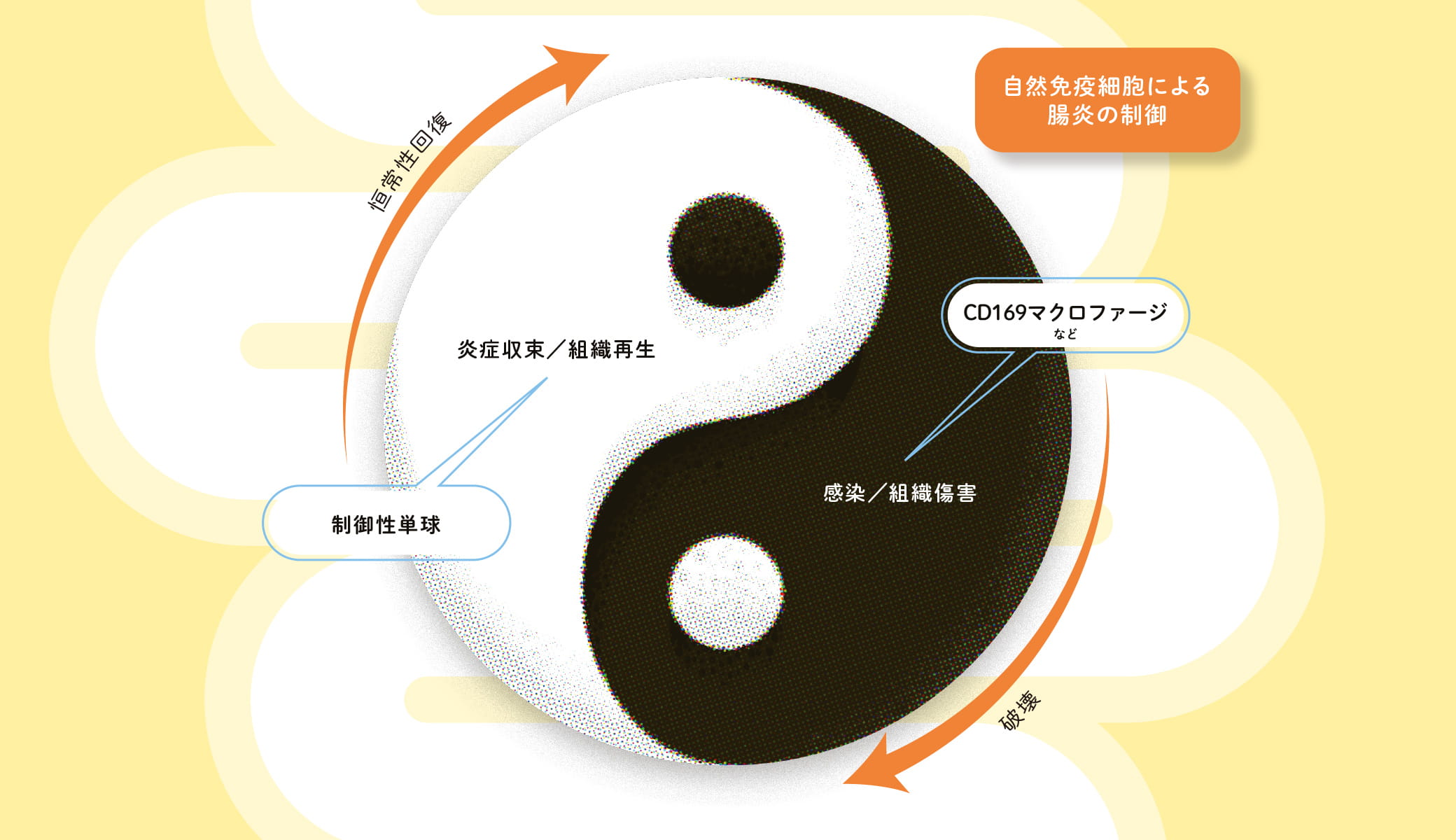
「体内に病原体などが侵入し、感染したり組織が傷害を受けたりすると、マクロファージが急性炎症を惹起し、異物を排除します」と浅野准教授は免疫応答の仕組みを説明する。マクロファージの破壊力は大きく、次第に病原体だけでなくその周りにも炎症を引き起こし、二次的な組織傷害を起こしていく。「ところが興味深いことに、マクロファージは病原体への攻撃が終わると炎症を収束させるばかりか、炎症で傷ついた組織の修復も助けることがわかっています」と続けた浅野准教授。免疫細胞が異物を攻撃・排除し、また反対に傷ついた組織を再生させる。こうして破壊と再生が繰り返されることで身体の恒常性は保たれているという。
だがマクロファージはいったいどうやって炎症の促進と収束、破壊と再生というまったく反対の作用を引き起こしているのか。この疑問に対し、浅野准教授は「骨髄では破壊を司るマクロファージと、再生を助けるマクロファージの2種類が作られているのではないか」と推測した。破壊を司るマクロファージが仕事を終えると、後から再生を助けるマクロファージが供給される。そうした巧妙なバックアップシステムを持っているのではないかというのだ。浅野准教授は腸炎の病態モデルを使ってこの仮説の実証を試みた。
マクロファージによって腸炎が進展するメカニズムを解明
炎症性腸疾患は、何らかの原因で腸管免疫系のバランスが崩れ、慢性的に炎症が起こる腸炎の一つだ。増悪と寛解を繰り返しながら徐々に悪化していくやっかいな疾患で、難病に指定されている。日本には約25万人もの患者がいるといわれており、治療法の開発が待たれている。
これまでの研究で浅野准教授は、腸管の上皮付近に常在する通常のマクロファージとは別に、腸上皮から離れた粘膜の深い領域に少量だけ分布しているCD169マクロファージの存在を突き止めている。今回改めてこの珍しいマクロファージに着目し、炎症性腸疾患を起こしたマウスを使ってCD169マクロファージの振る舞いを解析した。「マウスに炎症性腸疾患を誘導すると、激しい血便と体重減少を引き起こします。しかしCD169陽性マクロファージを消去したマウスに腸炎を誘導した場合は、ほとんど体重は減らず、炎症症状もほぼ抑制されました。このことからCD169陽性マクロファージが腸炎を悪化させる責任細胞の一つであることがわかりました」。
この結果は、CD169マクロファージの働きを抑えることで腸炎を治療できる可能性を示している。そこで浅野准教授は、研究室の大学院生と共にCD169マクロファージの作用をさらに詳しく調べた。CD169マクロファージで特に多く産生されるCCL8というタンパク質を発見。CD169マクロファージがCCL8タンパクを産生し、それが腸炎の進展に関与するメカニズムを明らかにした。
炎症で壊れた組織を回復させる制御性単球を突き止める
浅野准教授の仮説に従うと、CD169マクロファージが炎症を引き起こす攻撃的な免疫細胞だとすれば、炎症を収束し、組織を修復するマクロファージも存在するはずだ。その予測に基づいて探索した浅野准教授は、炎症の後期に骨髄で大量に産生される制御性単球を発見した。単球とはマクロファージの元になる血球細胞である。
「制御性細胞を消去したマウスでは、腸炎で減少した体重や組織傷害の回復が遅くなることがわかりました。これは、制御性単球が炎症を収束させ、傷ついた組織の修復を助けることを意味します」と浅野准教授。これにより炎症時の大腸には少なくとも2種類の単球・マクロファージが存在することが明らかになった。炎症性腸疾患で組織が傷害されると、CD169マクロファージが活性化し、異物を排除する。それが終わると再生ドライブが発動。Ym1陽性単球が骨髄から大量に供給されて炎症を収束し、組織修復を助ける。まるで陰陽のように組織の破壊と再生が繰り返される自然免疫細胞の制御機構を、浅野准教授は実証してみせた。
「制御性単球の働きをうまく利用すれば、炎症性腸疾患だけでなく、免疫異常によるさまざまな疾患の治療が可能になります」と浅野准教授。例えば制御性単球を増やす増殖剤を投与して炎症を抑えたり、あるいは体外で制御性単球を増やして体内に戻し、自己の制御性単球で炎症疾患を治療したりすることも可能になるかもしれないという。そのためにはまずヒトの制御性単球を見つけ出す必要がある。最近の研究で浅野准教授は、ヒトに存在する制御性単球を同定。現在、それを増やす仕組みも構築しつつある。
「免疫系の疾患には、まだ発症機序も治療法も見つかっていない難病が数多くあります。そうした疾患に新しい治療法を提供したい。それが生命科学研究者としての使命だと考えています」と浅野准教授は力を込めた。